
【题目】优质碳酸钙是制造牙膏的原料之一,某同学利用等质量同种石灰石制优质碳酸钙。设计如图所示的甲、乙两条路线(假设杂质不参与反应,每一步反应完全)。下列评价正确的是
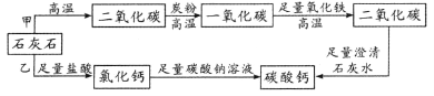
A.甲、乙方案制得碳酸钙质量相等,甲方案反应条件苛刻、过程复杂
B.甲、乙两方案制得碳酸钙质量相等,乙方案操作简单、安全可靠
C.甲方案制得碳酸钙是乙方案的2倍,温度高、反应速率快,比乙方案好
D.甲方案制得碳酸钙是乙方案的2倍,但乙的操作简单,反应环节少,综合起来比甲方案好
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6 H2O===CaO2·8H2O
反应时通常加入过量的Ca(OH)2,其目的是_____________。
(2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有____________(填序号)。
A.Ca2+ B.H+ C.CO32– D.OH
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L1表示),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种有机合成中间体,Z是常见的高分子化合物,某研究小组采用如下路线合成X和Z:
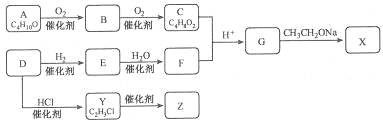
已知:①化合物A的结构中有2个甲基
②RCOOR′+R′′CH2COOR′![]()
![]()
请回答:
(1)写出化合物E的结构简式__________,F中官能团的名称是_________。
(2)Y→Z的化学方程式是____________。
(3)G→X的化学方程式是__________,反应类型是___________。
(4)若C中混有B,请用化学方法检验B的存在(要求写出操作、现象和结论)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡原理在工农业生产中发挥着重要的指导作用。
(1) 反应C(s)+CO2(g)![]() 2CO(g)平衡常数K的表达式为 ;
2CO(g)平衡常数K的表达式为 ;
已知C(s) + H2O(g) ![]() CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g) ![]() CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为 。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为 。
(2)已知某温度下,反应2SO2+O2![]() 2SO3,的平衡常数K=19 mol·L-1。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应是否达到化学平衡状态?计算过程和结论如下 :
2SO3,的平衡常数K=19 mol·L-1。在该温度下的体积固定的密闭容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应是否达到化学平衡状态?计算过程和结论如下 :
(3)若未达到,反应向 (填“正反应”或“逆反应”) 方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料认为NO、NO2不能与Na2O2反应。某小组学生提出质疑,从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出假设并进行探究:
假设Ⅰ.Na2O2能氧化NO2
假设Ⅱ.NO2能氧化Na2O2
(1)小组甲同学设计了如图实验装置,并进行如下实验:
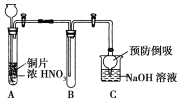
①试管A中发生反应的化学方程式是______________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带余烬的木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是______________________________。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;但带余烬的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是
_____________________________________________________________________。
(2)丙同学认为NO易被O2氧化,更易被Na2O2氧化。
查阅资料:①2NO+Na2O2===2NaNO2
②6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O
③酸性条件下,NO或NO都能与MnO反应生成NO和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
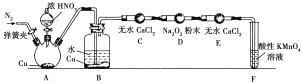
①A装置中盛装Cu片的仪器名称是__________,B中观察到的主要现象是______________________,F装置的作用是______________________________。
②在反应前,打开弹簧夹,通入一段时间N2,目的是______________________________。
③充分反应后,检验D装置中产物是NaNO2还是NaNO3的实验方法是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 糖类、油脂和蛋白质都是天然高分子化合物
B. 煤的干馏和石油的分馏都是化学变化
C. 苯的硝化反应属于取代反应
D. 油脂都不能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异戊二烯是重要的有机化工原料,其结构简式为CH2=C(CH3)CH=CH2。
完成下列填空:
(1)化合物X与异戊二烯具有相同的分子式,与Br2/CCl4反应后得到3-甲基-1,1,2,2-四溴丁烷。X的结构简式为_______________。
(2)异戊二烯的一种制备方法如下图所示:
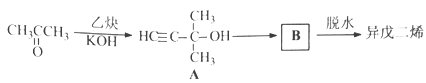
A能发生的反应有___________。(填反应类型)
B的结构简式为______________。
(3)设计一条由异戊二烯制得有机合成中间体 的合成路线。
的合成路线。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
② 金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com