
【题目】对Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=1.2×10﹣11)、AgCl(Ksp=1.56×10﹣10)三种物质,下列说法正确的是( )
A.Mg(OH)2的溶解度最小
B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小
D.同一温度下Ksp越大的溶解度也越大
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为; 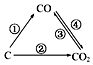
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正v逆(填“>”“<”或“=”).
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F﹣F | N﹣F |
键能/kJmol﹣1 | 941.7 | 154.8 | 283.0 |
则反应N2(g)+3F2(g)═2NF3(g)的△H=
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2
D.△H3=△H1﹣△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=﹣235.8kJmol﹣1 ,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJmol﹣1 ,
则O3转化为O2的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有以下离子中的全部或部分: Ag+、Fe3+、Al3+、H+、SO42-、CO32-、OH-、Cl-,取该溶液做以下实验:
①观察溶液外观, 溶液有颜色;
②取少量该溶液加入Ba(NO3)2溶液, 无现象;
③取该溶液 100 mL,向其中逐滴滴加 1 mol/L的NaOH溶液至过量,生成沉淀物质的量与所加入的 NaOH 溶液的体积关系如图所示。根据实验回答以下问题:
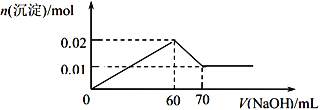
(1)检验溶液中阴离子的离子方程式为________________________________。
(2)根据以上实验推断,溶液中各离子的物质的量浓度分别为________________________________。
(3)若取以上溶液 100 mL,加入足量氨水后过滤,再将所得沉淀洗涤、灼烧,所得固体残留物的物质的量为_____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如表格:
| 0 | 2 | 4 | 6 | 8 | 10 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为%,表中c2c3、ab(填“>”、“<”或“=”).
(2)2min时四氧化二氮的浓度c1=mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为mol/(Lmin).
(3)100℃时,该反应的平衡常数K=
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NH4Cl和Ca(OH)2制取氨气,下图A和B是常用的气体发生装置。

(1)实验室制氨气时反应的化学方程式是______________________________________,应选用的装置是_____;若改用浓氨水和NaO固体制氨气时,应选取的装置是________。
(2)为了得到干燥的氨气,实验室常使用________做干燥剂(请从碱石灰、浓硫酸、氯化钠中选出一种物质)。
(3)实验室常用_______法收集氨气。在标准状况下,将盛满氨气的集气瓶倒置于水中(假设溶质全部在集气瓶内),则所得溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气设计了如下实验装置。
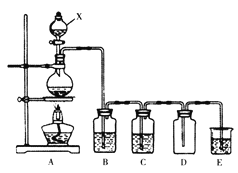
请按要求回答下列问题:
(1)仪器X的名称为_________________。
(2)已知装置B中选用的试剂为饱和食盐水,其作用为___________________。
(3)将氯气通入紫色石蕊试液C中可以观察到的现象是________________________。
(4)装置E中装有NaOH溶液,该装置中反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面两种方法可以制得白色的Fe(OH)2沉淀:
【方法一】用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应来制备。
实验室用硫酸亚铁晶体配制上述FeSO4溶液时,一般需加入铁粉和稀硫酸,加入铁粉的目的是_____________。
【方法二】在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂来制备。

(1)实验开始时,止水夹e是______(填“打开”或“关闭”)的。
(2)如何检验装置内空气已经排尽?________________。
(3)排尽装置内空气后,为了制得白色Fe(OH)2沉淀,操作步骤是________。
(4)开启活塞f放掉约2/3液体,此时裝置B中试剂瓶中发生的化学反应方程式为________。
(5)下列各图示中________(填序号)能较长时间看到Fe(OH)2白色沉淀。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com