
【题目】某溶液中只含有以下离子中的全部或部分: Ag+、Fe3+、Al3+、H+、SO42-、CO32-、OH-、Cl-,取该溶液做以下实验:
①观察溶液外观, 溶液有颜色;
②取少量该溶液加入Ba(NO3)2溶液, 无现象;
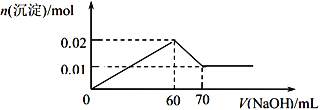
③取该溶液 100 mL,向其中逐滴滴加 1 mol/L的NaOH溶液至过量,生成沉淀物质的量与所加入的 NaOH 溶液的体积关系如图所示。根据实验回答以下问题:
(1)检验溶液中阴离子的离子方程式为________________________________。
(2)根据以上实验推断,溶液中各离子的物质的量浓度分别为________________________________。
(3)若取以上溶液 100 mL,加入足量氨水后过滤,再将所得沉淀洗涤、灼烧,所得固体残留物的物质的量为_____________mol。
【答案】 Ag++Cl-=AgCl↓ c(Fe3+) = c(Al3+)=0.1 mol/L ,c(Cl-) = 0.6 mol/L 0.01 mol
【解析】①观察溶液外观,溶液有颜色,则一定含有Fe3+,因此一定不存在CO32-、OH-;②取少量该溶液加入Ba(NO3)2溶液,无现象,说明不存在SO42-,根据溶液显电中性可知一定存在阴离子Cl-,所以不能存在Ag+;③根据图像可知加入氢氧化钠立即产生沉淀,所以不存在H+,沉淀达到最大值以后继续加入氢氧化钠,沉淀开始减少,但不完全消失,说明还含有Al3+。剩余沉淀是氢氧化铁,物质的量是0.01mol,则氢氧化铝沉淀是0.02mol-0.01mol=0.01mol,根据离子守恒可知溶液中铁离子、铝离子分别是0.01mol、0.01mol,根据电荷守恒可知氯离子的物质的量是0.06mol。
(1)溶液中阴离子是氯离子,检验溶液中阴离子的离子方程式为Ag++Cl-=AgCl↓。(2)根据以上实验推断,溶液中各离子的物质的量浓度分别为铁离子:0.01mol÷0.1L=0.1mol/L、铝离子:0.01mol÷0.1L=0.1mol/L、氯离子:0.06mol÷0.1L=0.6mol/L;(3)若取以上溶液100 mL,加入足量氨水后过滤,得到0.01mol氢氧化铁和0.01mol氧化铝,将所得沉淀洗涤、灼烧得到氧化铁和氧化铝,根据原子守恒可知所得固体残留物的物质的量为0.01mol÷2+0.01mol÷2=0.01mol。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,将11.2LCO2缓缓通入300mL2mol·L-1的NaOH溶液中,待充分反应后将所得溶液蒸干并充分灼烧,最后所得固体物质的质量为
A. 31.8g B. 53g C. 63.6g D. 84g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载“烧酒非古法也,自元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取其露。”这里用到的方法可用于分离( )
A.碳酸钙和硝酸钾B.碘单质和氯化钠C.四氯化碳和水D.乙醇和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列转化关系,回答有关问题: 
(1)B、C试剂分别是、 .
(2)①、⑤和⑥反应的化学方程式分别是: ①
⑤
⑥
(3)由图示转化关系可知淀粉(填“部分水解”或“完全水解”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O (g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)CO2(g)+H2(g),得到如表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O (g)的物质的量是 .
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”).
③若实验C中达到平衡所需时间 t3(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿主要成分Al2O3,还含少量 SiO2、Fe2O3杂质。可用下图制备铝:
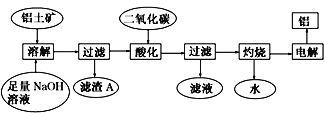
已知 2Na2SiO3+2NaAlO2+2H2O === Na2Al2Si2O8↓+4NaOH。 回答下列问题:
(1)在工艺流程第五步中,灼烧所需的实验仪器除酒精灯、坩埚、坩埚钳、玻璃棒之外,还需要_____________、_________________________。
(2)Na2Al2Si2O8的氧化物形式为_________________________。
(3)滤渣A经多步可制得粗硅 ,请写出由二氧化硅制得粗硅的化学方程式________________。
(4)在工艺流程第三步中,通入过量的二氧化碳时,该反应的离子方程式有_______________, 得到的滤液与足量Ba(OH)2溶液反应的主要离子方程式为 ____________________。
(5)将a g铝土矿经过以上一系列操作之后,最终得到b g Al(不考虑实验过程中操作引起的损耗), 下列说法正确的是____________。 (NA表示阿伏加德罗常数)
A.铝土矿中 Al3+数目小于![]()
B.铝土矿中Al2O3物质的量小于b/54 mol
C.铝土矿中铝元素的质量分数为![]() ×100℅
×100℅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=1.2×10﹣11)、AgCl(Ksp=1.56×10﹣10)三种物质,下列说法正确的是( )
A.Mg(OH)2的溶解度最小
B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小
D.同一温度下Ksp越大的溶解度也越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振氢谱图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的核磁共振氢谱如下图所示,则它可能是( ) 
A.CH3CH2CH3
B.CH3CH2CH2OH
C.(CH3)2CHCH3
D.CH3CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境、呵护地球已成为为类共同的呼声.①水是一种宝贵资源,保护水资源就是保护我们的生命.下列做法不利于水资源保护的(填字母编号);
A.科学合理使用农药 B.任意排放化工厂废水 C.处理生活污水,达标排放
②矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于(填“可回收物”或“可堆肥垃圾”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com