
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为; 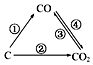
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正v逆(填“>”“<”或“=”).
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F﹣F | N﹣F |
键能/kJmol﹣1 | 941.7 | 154.8 | 283.0 |
则反应N2(g)+3F2(g)═2NF3(g)的△H=
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2
D.△H3=△H1﹣△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=﹣235.8kJmol﹣1 ,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJmol﹣1 ,
则O3转化为O2的热化学方程式为 .
【答案】
(1)C+CuO ![]() Cu+CO↑
Cu+CO↑
(2)等于
(3)>
(4)﹣291.9KJ?mol﹣1
(5)A
(6)2O3(g)═3O2(g)△H=﹣285kJ/mol
【解析】解:(1)C能将CuO中的铜置换出来,生成铜和CO,故化学方程式为C+CuO ![]() Cu+CO↑,所以答案是:C+CuO
Cu+CO↑,所以答案是:C+CuO ![]() Cu+CO↑;(2)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,途径Ⅰ和途径Ⅱ等量的煤燃烧消耗的氧气相等,两途径最终生成物只有二氧化碳,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量;所以答案是:等于;(3)该反应的浓度商=
Cu+CO↑;(2)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,途径Ⅰ和途径Ⅱ等量的煤燃烧消耗的氧气相等,两途径最终生成物只有二氧化碳,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量;所以答案是:等于;(3)该反应的浓度商= ![]() =
= ![]() =1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,所以答案是:>;(4)因为反应热等于反应物的总键能减去生成物的总键能,所以反应N2(g)+3F2(g)=2NF3(g)△H=(941.7+3×154.8﹣283.0×6)KJmol﹣1=﹣291.9KJmol﹣1 , 所以答案是:﹣291.9KJmol﹣1;(5)①2H2O(g)=2H2(g)+O2(g)△H1;②H2(g)+Cl2(g)=2HCl(g)△H2 ;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3;则反应③=①+2×②,由盖斯定律可知,△H3=△H1+2△H2 , 故选:A;(6)Ⅰ、6Ag(s)+O3(g)═3Ag2O(s),△H=﹣235.8kJmol﹣1 , Ⅱ、2Ag2O(s)═4Ag(s)+O2(g),△H=+62.2kJmol﹣1 , 根据盖斯定律可知Ⅰ×2+Ⅱ×3可得到,2O3(g)═3O2(g),则反应热△H=(﹣235.8kJmol﹣1)×2+(+62.2kJmol﹣1)×3=﹣285kJ/mol,所以答案是:2O3(g)═3O2(g)△H=﹣285kJ/mol.
=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,所以答案是:>;(4)因为反应热等于反应物的总键能减去生成物的总键能,所以反应N2(g)+3F2(g)=2NF3(g)△H=(941.7+3×154.8﹣283.0×6)KJmol﹣1=﹣291.9KJmol﹣1 , 所以答案是:﹣291.9KJmol﹣1;(5)①2H2O(g)=2H2(g)+O2(g)△H1;②H2(g)+Cl2(g)=2HCl(g)△H2 ;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3;则反应③=①+2×②,由盖斯定律可知,△H3=△H1+2△H2 , 故选:A;(6)Ⅰ、6Ag(s)+O3(g)═3Ag2O(s),△H=﹣235.8kJmol﹣1 , Ⅱ、2Ag2O(s)═4Ag(s)+O2(g),△H=+62.2kJmol﹣1 , 根据盖斯定律可知Ⅰ×2+Ⅱ×3可得到,2O3(g)═3O2(g),则反应热△H=(﹣235.8kJmol﹣1)×2+(+62.2kJmol﹣1)×3=﹣285kJ/mol,所以答案是:2O3(g)═3O2(g)△H=﹣285kJ/mol.


科目:高中化学 来源: 题型:
【题目】下列反应中,硝酸只表现氧化性的是( )
A.3FeO+10HNO3═3Fe(NO3)3+NO↑+5H2O
B.C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
C.Al(OH)3+3HNO3═Al(NO3)3+3H2O
D.3Zn+8HNO3═3Zn(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
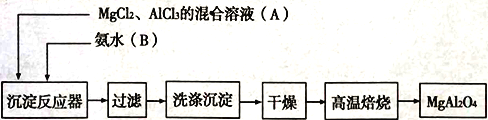
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应容器中加入________(填“A”、或“B”),再滴加另一反应物。
(2)实验室利用氯化铵和熟石灰反应制取氨气,写出反应的化学方程式________________________。
(3)判断流程中沉淀是否洗净所用的试剂是______________;高温焙烧时,用于盛放固体的仪器名称是__________________。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

①写出装置A 中发生反应的离子方程式________________________。
②装置B中盛放饱和NaCl溶液,该装置的主要作用是__________;F中试剂的作用是__________;
用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________。
③实验步骤:如图连接装置后,先__________(填实验操作),再装药品,然后点燃______(填“ A” 或“C” )处酒精灯,当________(填实验现象)时,再点燃另一处酒精灯。
④写出装置G 中发生反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载“烧酒非古法也,自元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取其露。”这里用到的方法可用于分离( )
A.碳酸钙和硝酸钾B.碘单质和氯化钠C.四氯化碳和水D.乙醇和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:![]()
①写出由纯SiHCl3制备高纯硅的化学反应方程式。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、
HCl和另一种物质,写出配平的化学反应方程式;H2
还原SiHCl3过程中若混有O2 , 可能引起的后果是。
(2)下列有关硅材料的说法正确的是( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,
振荡。写出实验现象并给予解释(用化学方程式说明)。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是________(填字母)。
A.高温结构陶瓷
B.生物陶瓷
C.导电陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列转化关系,回答有关问题: 
(1)B、C试剂分别是、 .
(2)①、⑤和⑥反应的化学方程式分别是: ①
⑤
⑥
(3)由图示转化关系可知淀粉(填“部分水解”或“完全水解”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O (g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)CO2(g)+H2(g),得到如表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O (g)的物质的量是 .
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”).
③若实验C中达到平衡所需时间 t3(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=1.2×10﹣11)、AgCl(Ksp=1.56×10﹣10)三种物质,下列说法正确的是( )
A.Mg(OH)2的溶解度最小
B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小
D.同一温度下Ksp越大的溶解度也越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应转化关系(未配平)肯定不正确的是( )
A. S+NaOH→Na2SO3+K2S+H2O B. FeO+HNO3→Fe(NO3)3+H2O
C. Cu2O+H2SO4→CuSO4+Cu+H2O D. NH4NO3→N2+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com