
����Ŀ���������ȣ�ClO2�����Գ�ȥ��ҵ��ˮ�е��軯���Ӧ�����ӷ���ʽΪ��2ClO2+2CN-=2CO2��+N2��+2Cl-
���������գ�
��1��������Ӧ���漰Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳����___������ԭ�Ӻ���������δ�ɶԵ��ӵ�Ԫ����___����Ƚ�̼�͵�Ԫ�طǽ�����ǿ��___����һ����ѧ��Ӧ����ʽ��ʾ����
��2���������Ȼ����Գ�ȥ��ˮ�е������ӣ�����ƽ���·�Ӧ��___��
ClO2+MnSO4+H2O��MnO2��+HCl+H2SO4
����Ӧ������0.2molMnO2�������ת��___����
��3���ȵ���һ��������Cl2Oÿ��ԭ�Ӷ��ﵽ8�����ȶ��ṹ�����ĵ���ʽΪ___��
��4����һ�ִ������軯����ˮ�ķ����ǵ�ⷨ�������ж�CN-����___���ϣ�ѡ���ţ�����������������Ӧ��CO2��N2���жϵ�������___��
���𰸡�Cl��C��N��O C��O NaHCO3+HNO3=NaNO3+H2O+CO2����Na2CO3+2HNO3=2NaNO3+H2O+CO2�� 2ClO2+5MnSO4+6H2O=5MnO2��+2HCl+5H2SO4 0.4NA��2.408��1023 ![]() �� CN-��������CO2��N2��ʧ���ӣ����ʱ��������ʧ���ӵ���������
�� CN-��������CO2��N2��ʧ���ӣ����ʱ��������ʧ���ӵ���������
��������
(1)2ClO2+2CN-=2CO2��+N2��+2Cl-��Ӧ���漰��Ԫ����Cl��O��C��N������ԭ�Ӱ뾶�ı仯���ɷ����ж�ԭ�Ӱ뾶�Ĵ�С��˳��������Ԫ��ԭ�ӵĵ����Ų�ʽ�����ж�ԭ�Ӻ���������δ�ɶԵ��ӵ�Ԫ�ء���������Դ���̼�ᣬ�ܹ�˵�����ķǽ����Դ���̼���ݴ˷������
(2)���ݻ��ϼ������غ���ƽ����ʽ���������ԭ��Ӧ�Ĺ��ɼ��㣻
(3)Cl2Oÿ��ԭ�Ӷ��ﵽ8�����ȶ��ṹ��������д�������Cl-O���ۼ����ݴ˷�����д����ʽ��
(4)�õ�ⷨ�������軯����ˮ����CN-ת��ΪCO2��N2�����ݻ��ϼ۵ı仯��ϵ��ԭ���������
(1)2ClO2+2CN-=2CO2��+N2��+2Cl-��Ӧ���漰��Ԫ����Cl��O��C��N��ͬһ���ڣ�������ң�ԭ�Ӱ뾶��С��ͬһ�������϶��£�ԭ�Ӱ뾶������ԭ�Ӱ뾶�ɴ�С��˳��ΪCl��C��N��O������Ԫ��ԭ�ӵĵ����Ų�ʽ�ֱ�Ϊ1s22s22p63s23p5��1s22s22p2��1s22s22p3��1s22s22p4������ԭ�Ӻ���������δ�ɶԵ��ӵ�Ԫ����C��O�����ķǽ����Դ���̼����Ϊ��������Դ���̼�ᣬNaHCO3+HNO3=NaNO3+H2O+CO2����Na2CO3+2HNO3=2NaNO3+H2O+CO2�����ʴ�Ϊ��Cl��C��N��O��C��O��NaHCO3+HNO3=NaNO3+H2O+CO2����Na2CO3+2HNO3=2NaNO3+H2O+CO2����
(2)���ݻ��ϼ������غ㣬ClO2+MnSO4+H2O��MnO2��+HCl+H2SO4��Ӧ��Cl��+4�۽���Ϊ-1�ۣ�����5��Mn��+2�����ߵ�+4�ۣ�����2����С������Ϊ10����ƽ��2ClO2+5MnSO4+6H2O=5MnO2��+2HCl+5H2SO4������Ӧ������0.2molMnO2��ת��0.4mol���ӣ���ĿΪ0.4NA��2.408��1023���ʴ�Ϊ��2ClO2+5MnSO4+6H2O=5MnO2��+2HCl+5H2SO4��0.4NA��2.408��1023��
(3)�ȵ���һ��������Cl2Oÿ��ԭ�Ӷ��ﵽ8�����ȶ��ṹ��������д�������Cl-O���ۼ�������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(4)�õ�ⷨ�������軯����ˮ����CN-ת��ΪCO2��N2����CN-��������CO2��N2��ʧȥ���ӣ����ʱ��������ʧ���ӵ��������̣����CN-���������ϱ��������ʴ�Ϊ���ڣ�CN-��������CO2��N2��ʧ���ӣ����ʱ��������ʧ���ӵ��������̡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe3O4����Ҫ�Ļ�ѧ�Լ���������������ȼ������ȡ����Ϊ�����Ϳ�ݵķ�����ͼ1����ȡ������������ϵ��װ�ã�Aװ��������ȡ������̼���壬��Ҫ�������ȶ������ٿɿء�
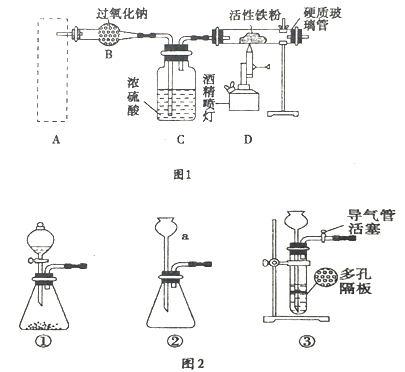
��ش��������⣺
��1��ͼ2������a��������___________��
��2��������ĿҪ����ͼ2�����ѡ��______������ţ���ΪAװ�ã�
��3����ͼ2��װ�âٽ��������Լ��ķ�����___________�����Һ©���м�����ˮ����һ�����ˮ�����µΣ�˵��װ�âٵ����������ã�
��4����Bװ���з�����Ҫ��Ӧ�Ļ�ѧ����ʽ��_________________��
��5��������������������Ԥ�ȵ����۽Ӵ�ʱ����Ӳ�ʲ������н��۲쵽������������___________________________________________��
��6�������۱���ȫ���ģ�ijͬѧΪȷ������������+2������ȡ�������������Թ��У�����������ϡ�����ܽ⣮
��д���ܽ���̷�����Ӧ�����ӷ���ʽ_____________________________��
��д��ȷ��+2���������Լ����ơ��������衢ʵ������ͽ���___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�������300����70MPa���ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ��2CO2��g��+6H2��g��![]() CH3CH2OH��g��+3H2O��g�������������������
CH3CH2OH��g��+3H2O��g�������������������
A.ʹ��Cu-Zn-Fe�����ɴ���������Ч��
B.��Ӧ����300�����п��Ʋ�÷�Ӧ�����ȷ�Ӧ
C.�������CO2��������H2��ת����
D.��ƽ���������з����CH3CH2OH��H2O�����CO2��H2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼������ȡ����Ļ�ѧ����ʽΪ��Al4C3+12H2O=4Al(OH)3��+3CH4���������йػ�ѧ�����ʾ��ȷ���ǣ� ��
A.�����ӵĵ����Ų�ʽ��1s22s22p63s23p1
B.ˮ���ӵĽṹʽ��H��O��H
C.����ı���ģ�ͣ�![]()
D.���������ĵ��뷽��ʽ��H++AlO2-+H2O=Al(OH)3=Al3++3OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ���л�����ԭ�ϣ�����������ϩΪԭ���Ʊ��ij����л����ʾ��ͼ��
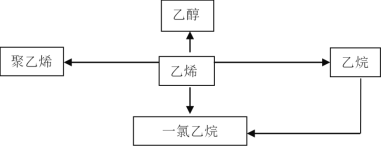
��1����ϩ�ĵ���ʽΪ________________����ͬϵ���ͨʽΪ_____________��
��2����ҵ������ϩ�Ʊ��Ҵ��Ļ�ѧ����ʽΪ____________________________��
��3������ϩ��Ĥ������ʳƷ��װ���ϣ�д������ϩ�ƾ���ϩ�Ļ�ѧ����ʽ��_______���˷�Ӧ����Ϊ_______��Ӧ��
��4���Ʊ�һ�����鳣�����ַ��������������������ڹ��������·�Ӧ��ȡ��������ϩ�ڼ���ʹ�ô��������������Ȼ������巴Ӧ��ȡ���Ƚ������Ʊ�����������Ϊ�ȽϺ�����һ�֣�___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����(S2Cl2)����ƽ��ṹ����������һ�ֻƺ�ɫҺ�壬�д̼��Զ�����۵�80�棬�е�135.6�棬�Ըɶ��Ȼ�����������ȷ����
A.���Ȼ�����ĵ���ʽΪ![]()
B.�����м��м��Լ����зǼ��Լ�
C.���Ȼ��������ڷǼ��Է���
D.������S��Cl����С��S��S���ļ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֲ�ͬ�ѻ���ʽ�Ľ�������ľ�����ͼ��ʾ���й�˵����ȷ����(���������Ħ������ΪMg��mol-1����ԭ�Ӱ뾶Ϊr cm����NA��ʾ�����ӵ�������ֵ)

A.����Zn���âڶѻ���ʽ
B.�ٺ͢���ԭ�ӵ���λ���ֱ�Ϊ��6��8
C.���ڲ��âڶѻ���ʽ�Ľ����ľ�������Ϊ![]()
D.������ѹʱ�����ƻ��ܶѻ������з�ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ������ȷ���ǣ� ��
A.��FeBr2 ��Һ��ͨ�����Cl2��2Fe2++Cl2 =2Fe3++2Cl-
B.��̼������Һ��ͨ������CO2��![]() +CO2+H2O=2
+CO2+H2O=2![]()
C.��⻯����Һ�м������������ữ��H2O2��Һ��3H2O2 +I-=![]() +3H2O
+3H2O
D.Fe(OH)3 �������� HI ��Һ��Fe(OH)3+3H+=Fe3++3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Na2CO3 ��NaHCO3�������ж���ȷ����![]() �� ��
�� ��![]()
A.�������ܽ�ȣ�Na2CO3<NaHCO3
B.���ȶ��ԣ�Na2CO3<NaHCO3
C.��ͬŨ�����ᷴӦ�ľ��ҳ̶ȣ�Na2CO3>NaHCO3
D.�����ʯ��ˮ��Ӧ�����а�ɫ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com