
【题目】右图是氢氧燃料电池构造示意图。关于该电池说法正确的是( )。
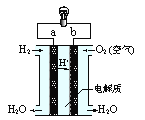
A.b是负极
B.需要点燃该电池才能开始工作
C.工作时能观察到淡蓝色火焰
D.氢氧燃料电池是一种高效环境友好的发电装置
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列对相应有机物的描述完全正确的是( )
①甲烷:与氯气在光照条件下反应生成的CH2Cl2有两种结构
②乙烯:可发生加成反应和加聚反应,其产量可以用来衡量一个国家石油化工发展水平
③苯:12个原子共平面,1mol苯中含有3mol碳碳双键
④乙醇:常温下具有特殊香味的液体,常用作调味品,也可以用来杀菌消毒
⑤油脂:属于酯类,在碱性条件下发生水解反应生成甘油和高级脂肪酸,称为皂化反应
⑥蔗糖:糖尿病人尿液的成分之一,可以用新制Cu(OH)2检验
⑦蛋白质:水解的最终产物为氨基酸,部分蛋白质遇浓硝酸显黄色
A.②④⑤⑦B.②④⑦C.①②③⑤⑥⑦D.②④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的化工原料,用途广泛。
(1)合成氨工厂常用醋酸二氨合铜(由[Cu(NH3)2]+和CH3COO-构成)溶液吸收对氨合成催化剂(铁粉)有毒害的CO气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是 。(填元素符号)
②醋酸二氨合铜所含元素的单质,所属的晶体类型有 (填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
③第4周期中,基态原子与基态Cu原子未成对电子数目相同的元素有 种(不包括Cu)。
④铜单质为面心立方晶体,其晶胞如图。如果Cu的原子半径为a cm,阿伏加德常数的值为NA,则此种Cu单质的密度表达式为 g/cm3。(相对原子质量Cu:64)


(2)BF3气体与NH3相遇立即生成一种白色晶体:BF3+ NH3=F3B—NH3。写出两种与BF3具有相同空间构型的阴离子 、 。
(3)NH3可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。该物质在水溶液中以SO42-和N4H44+两种正四面体构型的离子存在。N4H44+遇碱生成一种形似白磷的N4分子。画出N4H44+的结构(标明其中的配位键) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯: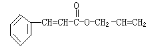 可简化为
可简化为![]() 杀虫剂“阿乐丹”的结构表示为
杀虫剂“阿乐丹”的结构表示为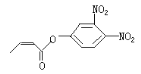 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.均能发生银镜反应 B.遇FeCl3溶液均显紫色
C.均能与NaHCO3溶液发生反应 D.均能与浓溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】联合生产是实现节能减排的重要措施,工业上合成氨和硝酸的联合生产具有重要意义。下面是工业上合成氨的简易流程:


(1)设备A内部结构如右下图所示,其名称是________ ,其中发生的化学反应方程式为_________;生产中原料气必须进行脱硫,目的是____________。选择500℃进行反应的主要原因是___________;
(2)设备B的名称是冷凝塔,图中a和b是两个通水口,其中入水口是 (填“a”或“b”)。
(3)氮气和氢气的混合气体通过压缩机压缩的原因是________________________________。
(4)生产出来的NH3可以用来生产硝酸。其中在氨气催化氧化过程中,不同温度下生成产物可能有所不同,温度对氨氧化产物产率的影响如下图所示;当温度大于900℃时,NO的产率下降的主要原因是__________________。

(5)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其它损耗)的 %(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~H 8种元素在周期表中的位置:

(1)8 种元素中化学性质最不活泼的是_________(填元素符号);
(2)元素E、F的最高价氧化物对应的水化物反应的离子方程式为______________;
(3)元素D的最低价的氢化物与单质G发生反应的化学方程式为_______________;
(4)写出元素A、C形成的化学式为CA5的电子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷的用途很广泛。
(1)已知:
2NO2(g )![]() N2O4(g) △H= -56.9kJ·mol -1
N2O4(g) △H= -56.9kJ·mol -1
H2 O(g)= H2O(l) △H= -44.0kJ·mol -1
CH4(g)+N2O4 (g)= N2(g)+2H2O(l)+CO2 (g) △H=-898.1kJ·mol -1
则 CH4 (g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为_____________________。
(2)一定条件下,发生2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:

①该温度下,该反应的平衡常数表达式为K =_____________________;
②计算前4秒内氮气的平均反应速率为____________________;
③下列选项中,不能说明上述反应已达平衡的是( )
A.2v正(NO)= v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示

①该燃料电池的正极为_______________(填“a”或“b”)。该电池负极的电极反应式为_____________;
②放电一段时间后,电解质溶液的pH___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | ||||||||||||||||
c | d | e | |||||||||||||||
f | g | ||||||||||||||||
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
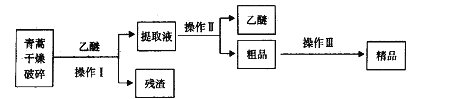
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,操作Ⅱ的名称是_________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是____________,装置F中盛放的物质是______________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
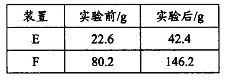
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
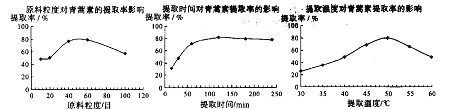
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com