
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
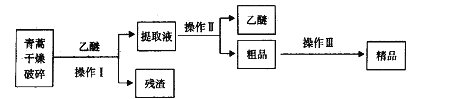
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,操作Ⅱ的名称是_________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是____________,装置F中盛放的物质是______________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
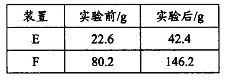
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
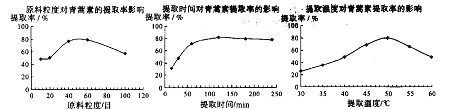
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
【答案】(1)增大青蒿与乙醚的接触面积,提高青蒿素的浸取率。(2)漏斗、玻璃棒;蒸馏
(3) B(4)①CaCl2或P2O5;碱石灰;②在装置F后连接一个防止空气中的CO和水蒸气进入F的装置;
③C15H22O5;(5)C;(6)B。
【解析】
试题分析:(1)对青蒿进行干燥破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸出率,故答案为:增大青蒿与乙醚的接触面积,提高青蒿素的浸出率;
(2)操作Ⅰ用于分离固体和液体,则可用过滤的方法分离,选择玻璃仪器为烧杯、玻璃棒、漏斗,操作Ⅱ用于分离乙醚,可用蒸馏的方法,故答案为:玻璃棒、漏斗;蒸馏;
(3)依据题干信息分析可知,青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,乙醚沸点为35℃便于除去,A选项青蒿素不溶于水,C选项分液得到的还是混合液,B.加95%的乙醚,浓缩、结晶、过滤是提纯的实验方法,
故答案为B;
(4)为了能准确测量青蒿素燃烧生成的CO2和H2O,实验前应通入除去CO2和H2O的空气,排除装置内的空气,防止干扰实验.E和F一个吸收生成的H2O,一个吸收生成的CO2,应先吸水后再吸收CO2,所以E内装的CaCl2或P2O5,而F中为碱石灰,而在F后应再加入一个装置防止外界空气中CO2,和H2O进入的装置,
①根据上面的分析可知,装置E中盛放的物质是 CaCl2或P2O5,装置F中盛放的物质是 碱石灰,故答案为:CaCl2或P2O5;碱石灰;
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是 在装置F后连接一个防止空气中的CO和水蒸气进入F的装置,故答案为:在装置F后连接一个防止空气中的CO和水蒸气进入F的装置;
③由数据可知m(H2o)=42.4-22.6=19.8g,所以n(H2o)=1.1mol,m(co2)=146.2-80.2=66g,所以n(co2)=1.5mol,所以青蒿素中氧原子的质量为m(o)=28.2-(2.2×1)-(1.5×12)=6g,所以n(o)=0.5mol,N(C):N(H):N(o)=1.5:2.2:0.5=15:22:5,所以C15H22O5,故答案为:C15H22O5;
(5)由于酯能溶于水,能在氢氧化钠溶液中水解并消耗氢氧化钠结合题意可知,青蒿素中含有酯基,故选C;
(6)根据原料的粒度对青蒿素提取速率的影响可知,应为60目,根据提取时间对青蒿素提取速率的影响可知,时间应为120分钟,根据提取温度对青蒿素提取速率的影响可知,温度应为50℃,故选B。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】右图是氢氧燃料电池构造示意图。关于该电池说法正确的是( )。
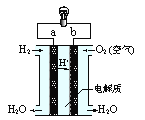
A.b是负极
B.需要点燃该电池才能开始工作
C.工作时能观察到淡蓝色火焰
D.氢氧燃料电池是一种高效环境友好的发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双安妥明是一种降血脂药物,主要用于降低血液中胆固醇浓度,安全,副作用小,其结构简式为 。已知:
。已知:
Ⅰ.![]()
![]()
Ⅱ.![]()
双安妥明的合成路线如下:

已知:C的分子式为C4H8,且支链有一个甲基;Ⅰ能发生银镜反应且1molI能与2mol氢气发生加成反应;K的结构具有对称性.试回答下列问题:
①写出结构简式:A_________,J _________,C化学名称_________。
②反应(2)的条件是_________,反应(3)的类型是_________。
③写出反应(4)的化学方程式_________。
④与F互为同分异构体,且属于酯类的有机物,写出其中能发生银镜反应的有机物的结构简式_________、_________。
⑤与丙烯酸互为同系物,且相对分子质量为100,其结构共有_________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究金属铜与一定物质的量浓度的HNO3反应,将制得的气体通过浓硫酸后被完全吸收,由此做出猜想:①NO2溶于浓硫酸或与浓硫酸反应;②NO溶于浓硫酸或与浓硫酸反应,并进行下列实验:
实验一:将制得的纯净的NO2通入浓硫酸中,溶液变成棕黄色,加热浓硫酸,气体逸出,溶液颜色褪去;
实验二:将制得的纯净的NO通过浓硫酸后用排水集气法收集到足量无色气体,通入氧气后气体变成红棕色;
(1)由此得出的结论是___________________。
(2)查阅资料得知:NO、NO2等体积通入浓硫酸中反应生成NOHSO4(其中氮化合价为+3价),气体被全部吸收,试写出此反应的化学方程式_____________________。
(3)为制得干燥的NO2,可将湿润的NO2通过________干燥。也可用Pb(NO3)2加热得含有NO2
的混合气体,并用冰盐水冷却后可得到纯净的液态N02 , 己知Pb(NO3)2受热分解的产物中有PbO ,试写出加热Pb(NO3)2反应的方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________。
(3)N2F2分子中N原子的杂化方式是__________,l mol N2F2含有__________molσ键.
(4)NF3的键角__________NH3的键角(填“<”“>”或“=”),原因是__________.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________.
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为__________,Na2O晶体的密度为__________gcm-3(只要求列算式,不必计算出结果)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:
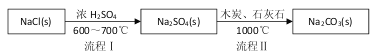
(1)流程I的另一产物是____,流程Ⅱ的反应分步进行:a. ![]()
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为__________________。
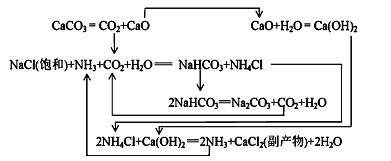
Ⅱ.1862年,比利时人索尔维(ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:
20℃时一些物质在水中的溶解度/g(100gH2O)
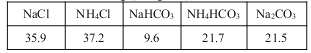
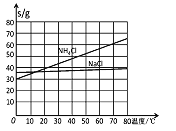
(2)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________。
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:_________、__________、_________。
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率。
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在________(填温度范围)下析出________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 。
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60mL0.50mol·L-1的盐酸跟60mL0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会_____(均填“偏大”“偏小”“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)39H2O]的流程如图甲:
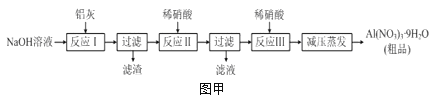
(1)写出反应Ⅰ的离子方程式:______________________________________________。
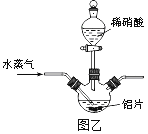
(2)若用图乙所示实验装置制取Al(NO3)3,通入水蒸气的作用是__________________。
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是__________。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和某气体。已知:2NO2+2NaOH=NaNO2+NaNO3。为了确定生成气体的成分,某学生拟用下列装置进行实验。
①进行实验时装置接口正确顺序是A→________________________→F。
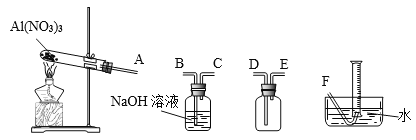
②证明分解生成的混合气体中有NO2的现象是_____________________。
③取21.3g Al(NO3)3加热分解,用排水法收集气体,最终在标准状况下收集到_____mL气体,结合化学方程式说明理由____________________________。
(5)设计实验证明粗品中含有Al(NO3)3:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物是化学与工业中运用广泛的物质。

(1)该小组利用电解原理设计了如右图装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极)。铂电极B是____极,钯电极A的电极反应式为_____________。
(2)若工业废水中的NO2- 的浓度约为1.0×10-4 mol·L-1 ,取工业废水5 mL 于试管中,滴加2滴0.1 mol·L-1 的硝酸银溶液,能否看到沉淀现象?试通过计算说明。(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol。请计算热化学方程式2H2(g) + S2(g) = 2H2S(g)的ΔH=___________
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

根据图中信息,如何说明水解反应速率随温度升高而增大:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com