
【题目】某小组探究金属铜与一定物质的量浓度的HNO3反应,将制得的气体通过浓硫酸后被完全吸收,由此做出猜想:①NO2溶于浓硫酸或与浓硫酸反应;②NO溶于浓硫酸或与浓硫酸反应,并进行下列实验:
实验一:将制得的纯净的NO2通入浓硫酸中,溶液变成棕黄色,加热浓硫酸,气体逸出,溶液颜色褪去;
实验二:将制得的纯净的NO通过浓硫酸后用排水集气法收集到足量无色气体,通入氧气后气体变成红棕色;
(1)由此得出的结论是___________________。
(2)查阅资料得知:NO、NO2等体积通入浓硫酸中反应生成NOHSO4(其中氮化合价为+3价),气体被全部吸收,试写出此反应的化学方程式_____________________。
(3)为制得干燥的NO2,可将湿润的NO2通过________干燥。也可用Pb(NO3)2加热得含有NO2
的混合气体,并用冰盐水冷却后可得到纯净的液态N02 , 己知Pb(NO3)2受热分解的产物中有PbO ,试写出加热Pb(NO3)2反应的方程式___________________。
【答案】(1)NO2溶于浓硫酸但不与浓硫酸反应,NO不溶于浓硫酸也不与浓硫酸反应
(2)NO+NO2+2H2SO4=2NOHSO4+H2O
(3)干燥的CaC12或P2O5;(2 分)2Pb(NO3) ![]() 2PbO+4NO2↑+O2↑
2PbO+4NO2↑+O2↑
【解析】
试题分析:(1)实验一:将制得的纯净的NO2通入浓硫酸中,溶液变成棕黄色,加热浓硫酸,气体逸出,溶液颜色褪去,说明NO2溶于浓硫酸但不与浓硫酸反应;实验二:将制得的纯净的NO通过浓硫酸后用排水集气法收集到足量无色气体,通入氧气后气体变成红棕色,说明NO不溶于浓硫酸也不与浓硫酸反应;故答案为:NO2溶于浓硫酸但不与浓硫酸反应,NO不溶于浓硫酸也不与浓硫酸反应;(2)NO、NO2等体积通入浓硫酸中反应生成NOHSO4,由原子守恒书写出方程式为NO+NO2+2H2SO4=2NOHSO4+H2O;(3)能溶于浓硫酸,所以不能用浓硫酸干燥NO2,NO2与无水氯化钙不反应,所以可以用无水氯化钙干燥NO2;Pb(NO3)2加热分解生成NO2和PbO、O2,反应方程式为:2Pb(NO3) ![]() 2PbO+4NO2↑+O2↑。
2PbO+4NO2↑+O2↑。


科目:高中化学 来源: 题型:
【题目】对复杂的有机物结构可用“键线式”表示。如苯丙烯酸1—丙烯酯: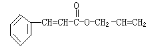 可简化为
可简化为![]() 杀虫剂“阿乐丹”的结构表示为
杀虫剂“阿乐丹”的结构表示为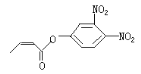 ,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
,若它在稀酸作用下能发生水解反应生成两种有机物,则此两种有机物具有的共同性质是( )
A.均能发生银镜反应 B.遇FeCl3溶液均显紫色
C.均能与NaHCO3溶液发生反应 D.均能与浓溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | ||||||||||||||||
c | d | e | |||||||||||||||
f | g | ||||||||||||||||
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是( )
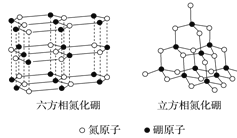
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池由A、B、C、D四种金属按下表中装置图进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________。
(2)装置乙中正极的电极反应式是________________________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
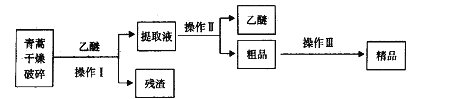
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,操作Ⅱ的名称是_________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是____________,装置F中盛放的物质是______________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
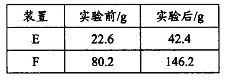
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
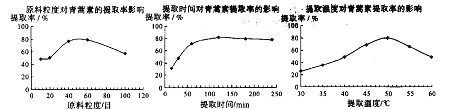
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl—)为原料生产CuCl的流程如下:
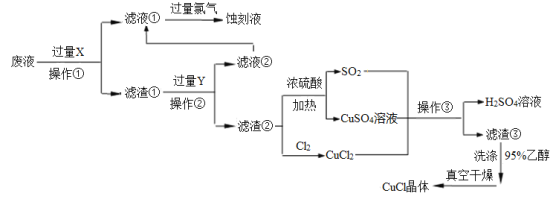
已知:CuCl是一种白色粉末,微溶于水,不溶于乙醇及稀硫酸,在水溶液中存在平衡:
CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
[CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
根据以上信息回答下列问题:
(1)试剂X是______,检验刻蚀液中金属阳离子的化学试剂是_____。(均填化学式)
(2)操作①、②、③相同,名称是________,所需要的主要玻璃仪器有烧杯、___ 、_____。
(3)滤渣①与Y反应的离子方程式为_________________。
(4)产生CuCl的化学方程式为_______________,当观察到 现象,即表明反应已经完全。
(5)在操作③之前往往向反应后的溶液中加入大量的水,其作用是 。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中含有K2SO3、K2CO3、FeO、MnO2等物质,现取X进行连续实验,实验过程及产物如下:
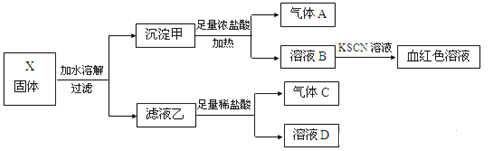
请回答:
(1)气体C的主要成分(填化学式)________。
(2)溶液B中存在的所有阳离子是___________________ 。
(3)沉淀甲中加浓盐酸产生气体A的离子方程式是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com