
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是( )
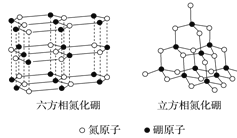
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+Y(g) == nZ(g)+2W(g) 1 min末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.005 mol·L-1·s-1 ,计算:
(1)前1 min内用X的浓度变化表示的平均反应速率。
(2)1 min末时Y的浓度。
(3)化学反应方程式中n的值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学所做的有关铜元素的实验流程如图:

(1)写出基态铜原子的价电子排布式________________________,向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键的类型有________________________。
(2)写出反应④的离子方程式________________________。
(3)铜能与类卤素(SCN) 2反应生成Cu(SCN) 2,1 mol (SCN)2分子中含有的δ键数目为类卤素(SCN)2对应的酸有两种,理论推测硫氰酸(H-S-C![]() N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为____________________。

(5)铜晶胞中,其晶体的堆积方式为_______________,一个晶胞中铜原子的数目为__________,空间利用率为____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双安妥明是一种降血脂药物,主要用于降低血液中胆固醇浓度,安全,副作用小,其结构简式为 。已知:
。已知:
Ⅰ.![]()
![]()
Ⅱ.![]()
双安妥明的合成路线如下:

已知:C的分子式为C4H8,且支链有一个甲基;Ⅰ能发生银镜反应且1molI能与2mol氢气发生加成反应;K的结构具有对称性.试回答下列问题:
①写出结构简式:A_________,J _________,C化学名称_________。
②反应(2)的条件是_________,反应(3)的类型是_________。
③写出反应(4)的化学方程式_________。
④与F互为同分异构体,且属于酯类的有机物,写出其中能发生银镜反应的有机物的结构简式_________、_________。
⑤与丙烯酸互为同系物,且相对分子质量为100,其结构共有_________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、按盐和纯碱等的原料。
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH 溶液作电解质溶液,则该电池负极电极反应式为_______________;正极反应式为______________。
(2)下列措施可以加快合成氨反应速率的是______________。
A.通过缩小容器的容积增大压强 B.及时将氨液化分离出去
C.适当升温 D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入lmolN2 和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则①从反应开始到25min时,以N2表示的平均反应速率为________;
②H2的平衡转化率为_______________;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=+116kJ·mol-1
③ H2O(l)=H2O(g);△H=+44kJ·mol-1
写出CO2 与NH3 合成尿素和液态水的热化学反应方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究金属铜与一定物质的量浓度的HNO3反应,将制得的气体通过浓硫酸后被完全吸收,由此做出猜想:①NO2溶于浓硫酸或与浓硫酸反应;②NO溶于浓硫酸或与浓硫酸反应,并进行下列实验:
实验一:将制得的纯净的NO2通入浓硫酸中,溶液变成棕黄色,加热浓硫酸,气体逸出,溶液颜色褪去;
实验二:将制得的纯净的NO通过浓硫酸后用排水集气法收集到足量无色气体,通入氧气后气体变成红棕色;
(1)由此得出的结论是___________________。
(2)查阅资料得知:NO、NO2等体积通入浓硫酸中反应生成NOHSO4(其中氮化合价为+3价),气体被全部吸收,试写出此反应的化学方程式_____________________。
(3)为制得干燥的NO2,可将湿润的NO2通过________干燥。也可用Pb(NO3)2加热得含有NO2
的混合气体,并用冰盐水冷却后可得到纯净的液态N02 , 己知Pb(NO3)2受热分解的产物中有PbO ,试写出加热Pb(NO3)2反应的方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________。
(3)N2F2分子中N原子的杂化方式是__________,l mol N2F2含有__________molσ键.
(4)NF3的键角__________NH3的键角(填“<”“>”或“=”),原因是__________.
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________.
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为__________,Na2O晶体的密度为__________gcm-3(只要求列算式,不必计算出结果)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 。
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60mL0.50mol·L-1的盐酸跟60mL0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会_____(均填“偏大”“偏小”“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正在研制的一种“高容量、低成本”锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电一段时间后右侧水溶液pH升高
B.整个反应过程中,铜相当于催化剂
C.通空气时,铜被腐蚀,表面产生CuO
D.放电时,正极的电极反应式为Cu2O+H2O+2e—=2Cu+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com