
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、按盐和纯碱等的原料。
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH 溶液作电解质溶液,则该电池负极电极反应式为_______________;正极反应式为______________。
(2)下列措施可以加快合成氨反应速率的是______________。
A.通过缩小容器的容积增大压强 B.及时将氨液化分离出去
C.适当升温 D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入lmolN2 和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则①从反应开始到25min时,以N2表示的平均反应速率为________;
②H2的平衡转化率为_______________;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=+116kJ·mol-1
③ H2O(l)=H2O(g);△H=+44kJ·mol-1
写出CO2 与NH3 合成尿素和液态水的热化学反应方程式_____________。
【答案】(1)2NH3-6e-+6OH-=N2+6H2O;O2+4e-+2H2O=4OH-
(2)A、C、D、E;(3)0.01mol/(L.min) 50%
(4)CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(l) △H=-87.0kJ/mol
【解析】
试题分析:(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH 溶液作电解质溶液,则该电池负极,NH3失去电子变为N2,负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O;在正极上氧气获得电子变为OH-,正极反应式为O2+4e-+2H2O=4OH-;(2)A.通过缩小容器的容积增大压强,使物质的浓度增大,化学反应速率增大,正确;B.及时将氨液化分离出去,由于物质浓度降低,所以化学反应速率减慢,错误;C.适当升温,可以使更多的分子变为活化分子,所以反应速率大大加快,正确; D.添加合适的催化剂,由于降低了反应的活化能,所以反应速率大大加快;E.恒温恒容时,再充入一定体积的氮气,由于反应物的浓度增大,所以化学反应速率大大加快,正确。(3) ①同一温度下,容器中气体压强与总的物质的量成正比,设平衡状态时混合气体的物质的量为x,16.80:12.60=(1+3)mol:x,x=(4mol×12.60)÷16.80=3,所以平衡时混合气体的物质的量为3mol,设参加反应的氮气的物质的量为y,
N2(g)+3H2(g) ![]() 2NH3(g)物质的量减少
2NH3(g)物质的量减少
1mol 2mol
y (4-3)mol
1mol:2mol=y:(4-3)mol,y=[1mol×(43)mol]÷2mol=0.5mol,则从反应开始到25min时,以N2表示的平均反应速率=V(N2)=(0.5mol÷2L)÷25min=0.01mol/(L.min);②H2反应的物质的量是3×0.5mol=1.5mol,反应开始时氮气的物质的量是3mol,所以N2的平衡转化率为(1.5mol÷3mol)×100%=50%;(4) ①+②-③,整理可得2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H=(-159.47kJ/mol)+(+72.49kJmol)-44kJ/mol=-87.0kJ/mol。


科目:高中化学 来源: 题型:
【题目】喷泉实验是一种常见的自然现象,其产生原因是存在压强差。在上图右图中的锥形 瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )

A. Cu与稀盐酸 B. NaHCO3与NaOH溶液
C. CaCO3与稀硫酸 D. NH4HCO3与稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石含碳酸镁和石英,制备高纯硅和硅胶的工艺流程如下:

(1)“硅胶”冶常用作_______________ ,也可以用作__________的载体。 A 的结构式为________。
(2)制备粗硅的方程式为_______。
(3)操作I为_____________,操作Ⅱ为_______________,操作Ⅲ所用仪器有铁架台(带铁圈)、酒精灯、_______________等。
(4)操作Ⅲ,需要在氯化氢气流中加热脱水的原因是_______________。
(5)溶液G用E酸化的方程式为_______________。
(6)电解饱和的K溶液的离子方程式为____________,阳极电极方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取: SO2(g)+Cl2(g)![]() SO2Cl2(g) △H
SO2Cl2(g) △H
针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H1=﹣aKJ·mol﹣1
2SOCl2(g) △H1=﹣aKJ·mol﹣1
②SO2Cl2+SCl2(g)=2SOCl2(g)△H2=﹣bKJ·mol﹣1
则△H= _______ kJ·mol﹣1(用含 a、b 的代数式表示,a>b>0)
(2)若在催化剂作用下,将nmol SO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P.起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L.
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示.则υ(SO2)=_______ mol/min。
②此温度下,该反应的K=________ L/mol。
③相同条件下,若将0.5nmolSO2与 0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是_______.
(3)该反应的产物 SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氟磷灰石[(Ca5(PO4)3F)]生产磷铵[(NH4)3PO4]并制取硫酸、联产水泥。其工艺流程如下图所示:
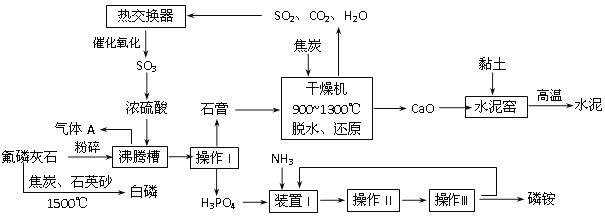
(1)操作I的名称________________;在实验室中操作II包括___________、____________。
(2)沸腾槽的材质是_______________(从“玻璃”、“钢铁”、“附有聚偏氟乙烯防腐层的石墨”中选择),选择的理由是__________________________________________________
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,反应方程式为:_________________________________________。
(4)黏土中有一种成分为石脂(Al2[OH]4Si2O5·nH2O),其用氧化物表示为____________。
(5)已知SO2的催化氧化反应为2SO2(g)十O2(g) ![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
从化学反应原理的角度说明催化氧化时使用热交换器的原因__________________。
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。拟用下图所示的装置测定硫酸尾气中SO2的含量:

若下列各组中的试剂,前者浓度为0.1mol·L-1,后者适量,溶液体积为5mL;通入尾气10L(已换算为标准状况)时反应管中的溶液恰好变色。判断下列试剂组能否测定硫酸尾气中SO2的体积分数。能者,确定SO2的体积分数;不能者,说明原因。
编号 | 试剂组 | 结论 |
① | NaOH溶液、酚酞试液 | |
② | Na2CO3溶液、酚酞试液 | |
③ | 碘水、淀粉溶液 | |
④ | KMnO4溶液、稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是( )
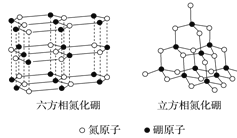
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:

(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是____________,其质量为____________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶_______∶________∶_________。
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”。下同)____________,H2SO4溶液的浓度____________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是_______________,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。
AsO33-+I2+2OH-。

当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是制备NH4NO3和Na2S2O4的一种工艺流程:(已知HNO2为弱酸)

(1)装置Ⅰ的作用为 ,写出该装置中反应的离子方程式 。
(2)若装置Ⅱ中产生的硝酸根和亚硝酸根的物质的量比为1∶1,写出反应的离子方程式_______;区别硝酸钠和亚硝酸钠晶体的方法是(写一种)______。
(3)装置Ⅳ中不通入氧气会产生的后果是________。
(4)若起始时通入等物质的量的NO和SO2,则通入n(NH3)∶ n(O2)=_________(假设过步骤中均完全转化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com