
【题目】下列是制备NH4NO3和Na2S2O4的一种工艺流程:(已知HNO2为弱酸)

(1)装置Ⅰ的作用为 ,写出该装置中反应的离子方程式 。
(2)若装置Ⅱ中产生的硝酸根和亚硝酸根的物质的量比为1∶1,写出反应的离子方程式_______;区别硝酸钠和亚硝酸钠晶体的方法是(写一种)______。
(3)装置Ⅳ中不通入氧气会产生的后果是________。
(4)若起始时通入等物质的量的NO和SO2,则通入n(NH3)∶ n(O2)=_________(假设过步骤中均完全转化)。
【答案】
(1)吸收SO2,分离NO和SO2 (2分) SO2+OH–= HSO3–(2分)
(2)2NO+3H2O+4Ce4+===NO3–+ NO2–+4 Ce3++6H+(2分)
测硝酸钠和亚硝酸钠晶体水溶液的pH(2分)
(3)会产生亚硝酸铵杂质(2分)
(4)2:1(2分)
【解析】
试题分析:
(1)由流程可知,二氧化硫被吸收;二氧化硫与氢氧化钠反应生成HSO3–;
(2)NO的产物NO3–、 NO2–,同时得到Ce3+,配平可得方程式;亚硝酸为弱酸,其盐水解溶液为碱性,据此可以区别;
(3)氧气的作用是把NO2–氧化为NO3–,不足或不通入会产生NH4NO2杂质;
(4)假设NO和SO2分别为1mol,根据元素守恒n(NH3)= n(NO3–)= n(NO)=1mol
根据电子守恒:3n(NO)= n(SO2)+ 4n(O2) n(O2)=0.5mol
n(NH3): n(O2)=1∶0.5=2∶1


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、按盐和纯碱等的原料。
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH 溶液作电解质溶液,则该电池负极电极反应式为_______________;正极反应式为______________。
(2)下列措施可以加快合成氨反应速率的是______________。
A.通过缩小容器的容积增大压强 B.及时将氨液化分离出去
C.适当升温 D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入lmolN2 和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则①从反应开始到25min时,以N2表示的平均反应速率为________;
②H2的平衡转化率为_______________;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=+116kJ·mol-1
③ H2O(l)=H2O(g);△H=+44kJ·mol-1
写出CO2 与NH3 合成尿素和液态水的热化学反应方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是____________________________________。
(2)装置乙中正极的电极反应式是_____________________________________,溶液中Cu2+向______极移动(填“B”或“C”)。
(3)当装置丙中产生3.36L(标准状况)气体时,电路中转移的电子数目为____________。
(4)四种金属活动性由强到弱的顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
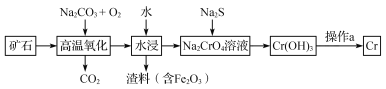
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为___________________________________。
③操作a由两种均发生了化学反应的过程构成的,其内容分别是_______________、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式____________________________。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol/L的铬酸 (H2CrO4) 溶液中各种含铬元素的微粒浓度分别为:c(![]() )=0.0005 mol·L1、c(
)=0.0005 mol·L1、c(![]() )=0.1035 mol·L1、c(
)=0.1035 mol·L1、c(![]() )=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
)=a mol·L1、则a=______,KHCrO4溶液中c(OH)___c(H+)(填“>”、“<”或“=”)。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。
①处理含有![]() 的污水方法通常为:用铁作电极电解污水,
的污水方法通常为:用铁作电极电解污水,![]() 被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol
被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_________________________,若要处理含10 mol ![]() 的污水,则至少需要消耗的铁为_______g。
的污水,则至少需要消耗的铁为_______g。
②转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含![]() 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。写出![]() 在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol
在酸性条件下被Fe2+还原为Cr3+ 的离子方程式:____________________________________,若处理含1 mol![]() (不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
(不考虑其它含铬微粒) 的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。CH3-CH=CH-CH3可简写为![]() 。有机物X的键线式为
。有机物X的键线式为
(1)有机物Y是X的同分异构体,且属于芳香烃, Y在一定条件能发生聚合反应,写出其化学方程式____________________________________________ 。
(2)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有___________ 种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正在研制的一种“高容量、低成本”锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电一段时间后右侧水溶液pH升高
B.整个反应过程中,铜相当于催化剂
C.通空气时,铜被腐蚀,表面产生CuO
D.放电时,正极的电极反应式为Cu2O+H2O+2e—=2Cu+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;该仪器使用前须检漏,检验方法为 。
(2)反萃取时加入20%的NaOH溶液,其离子方程式为 。
(3)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(4)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出;与传统工艺相比,萃取法的优点是 。
(5)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg·L―1,实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5mL 0.02mol·L―1溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol·L―1 KI溶液,振荡。
步骤4: ,再用0.01mol·L―1 Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)。
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg·L―1。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)![]() SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
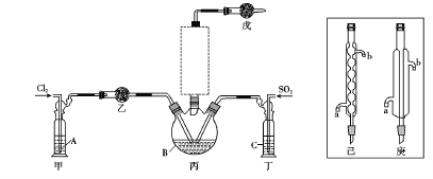
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为 ;溶液A为 。
②上图实框中仪器己的名称为 ;反应装置图的虚框中未画出的仪器是 (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是 。
④下列有关说法错误的是 (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为 %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,错误的是

A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③检查乙炔的还原性
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com