
【题目】二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃.沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。
(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)![]() SO2Cl2(g) △H<0
SO2Cl2(g) △H<0
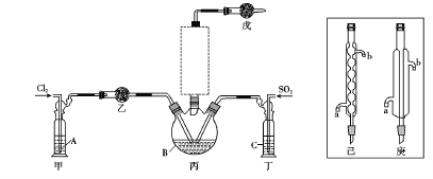
①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为 ;溶液A为 。
②上图实框中仪器己的名称为 ;反应装置图的虚框中未画出的仪器是 (填“己”或“庚”)。
③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是 。
④下列有关说法错误的是 (填编号)。
a.乙、戊装置相同,在实验中的作用也完全相同
b.甲、丁装置为洗气装置,可用于气体的除杂和干燥
c.组装仪器后首先要进行的操作是检查装置的气密性
d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等
(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是 。
(3)测定。取1.00g蒸馏后液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为 %。
(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是 。
【答案】(1)①16HCl(浓)+2KMnO4=5Cl2↑+2MnCl2+2KCl+8H2O;饱和的氯化钠溶液。
②球形冷凝管;己。
③该反应是放热反应,降低温度能使平衡向右移动,有利于二氯化砜的生成。 ④a
(2)降低二氯化砜的沸点,减少二氯化砜的分解。(3)92.70
(4)二氯化砜自身分解生成的氯气溶于二氯化砜中。
【解析】
试题分析:制备的二氧化硫中含有水蒸气,制备的氯气中含有HCl、水蒸气,SO2C12遇水剧烈反应,需要进行干燥与除杂,甲装置为除去氯气中HCl,盛放饱和食盐水,乙装置干燥氯气;丁装置干燥二氧化硫,可以盛放浓硫酸,戊防止空气中水蒸气进入丙中。
(1)①高锰酸钾溶液与浓盐酸反应的方程式为16HCl(浓)+2KMnO4=5Cl2↑+2MnCl2+2KCl+8H2O;除去氯气中的氯化氢可以使用饱和食盐水,即溶液A是饱和的氯化钠溶液;
②由仪器己的结构特征可知己为球形冷凝管;球形冷凝管冷凝面积较直形冷凝管大,冷凝效率稍高,故虚框中未画出的仪器最好选用己;
③该反应是放热反应,降低温度能使平衡向右移动,因此有利于二氯化砜的生成;
④a.乙、戊装置相同,乙是干燥氯气,戊防止空气中水蒸气进入丙中,作用不同,a错误;b.甲、丁装置为洗气装置,可用于气体的除杂和干燥,b正确;c.组装仪器后首先要进行的操作是检查装置的气密性,c正确;d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等,d正确,答案选a。
(2)SO2Cl2常温下比较稳定,受热易分解,减压蒸馏可以降低其沸点,防止分解;
(3)设所得馏分中二氯化砜的质量百分含量为x,则:
SO2Cl2~H2SO4~BaSO4
135 233
1.00g×x 1.6g
所以135:233=1.00g×x:1.6g
解得x=92.7%
(4)SO2Cl2久置后分解会生成氯气,可能是溶解氯气所致,因此久置后微显黄色的原因是二氯化砜久置后分解会生成氯气的溶解再二氯化砜中。


科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是_______________,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。
AsO33-+I2+2OH-。

当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是制备NH4NO3和Na2S2O4的一种工艺流程:(已知HNO2为弱酸)

(1)装置Ⅰ的作用为 ,写出该装置中反应的离子方程式 。
(2)若装置Ⅱ中产生的硝酸根和亚硝酸根的物质的量比为1∶1,写出反应的离子方程式_______;区别硝酸钠和亚硝酸钠晶体的方法是(写一种)______。
(3)装置Ⅳ中不通入氧气会产生的后果是________。
(4)若起始时通入等物质的量的NO和SO2,则通入n(NH3)∶ n(O2)=_________(假设过步骤中均完全转化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳整理是科学学习的重要方法之一。氧族元素的部分性质归纳整理如下:
|
|
|
|
|
单质熔点/℃ | -218,4 | 113 | ? | 450 |
单质沸点/℃ | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ? |
原子半径/nm | 0.074 | 0.102 | ? | 0.136 |
单质与氢化合的难易程度 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接 |
请根据上表数据以及数据变化趋势,回答下列问题:
(1)硒的熔点范围可能是:________________;
(2)碲(Te)可能的化合价有:___________________;
(3)硒(Se)的原子半径可能在_______________________之间。
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐_________(增强、减弱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热法炼铬废渣主要成分为Al2O3和Cr2O3,还含有MgO、FeO、Fe2O3等杂质,以下是以炼铬废渣为原料回收Al2O3和Cr2O3的流程图:

已知:
①“焙烧”涉及的主要反应:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
Cr2O3+Na2CO3+O2![]() Na2CrO4+CO2↑(未配平);
Na2CrO4+CO2↑(未配平);
②滤液2中涉及的反应:8CrO42--+3S2O32-+34H+===6SO42-+8Cr3++17H2O
③Ksp[Cr(OH)3]=8×10-32
根据题意回答下列问题:
(1)请完成下列化学方程式的配平:
Cr2O3+ Na2CO3+ O2 ![]() Na2CrO4+ CO2↑;
Na2CrO4+ CO2↑;
(2)炼铬废渣在焙烧前需球磨粉碎,其目的是 。
(3)滤渣1的主要成分是 。
(4)流程中可以循环利用的物质是 。
(5)写出步骤Ⅲ“碳分”的离子反应方程式: 。
(6)滤液2还原后的溶液中为使Cr3+沉淀完全,溶液pH应小于 。(已知:lg5=0.7;当溶液中离子浓度不大于1×10-5mol/L时,可以认为不含该离子)
(7)滤液2经多步操作还可以获得K2Cr2O7晶体,其操作依次是:加入稀硫酸酸化,加入KCl固体、蒸发浓缩、操作a、过滤、操作b、干燥。
①加硫酸酸化的目的是 。
②操作a、操作b分别是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】铁在工业和生活中都具有非常重要的应用。某含铁化合物W,为探究其成分,化学兴趣小组的同学取化合物W粉末进行试验。经组成分析,该粉末除Fe外还有O和另一未知元素共三种元素。另取2.22g化合物W的粉末溶于适量稀硫酸,向反应后的溶液中加入含有3.20gNaOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色粉末1.60g;将所得滤液在一定条件下蒸发灼烧可得到一种纯净的不含结晶水的盐7.10g。请回答:
(1)则另一未知元素为________(填化学式)。
(2)①该化合物W的化学式为________________。
②该化合物W与适量稀硫酸反应的化学方程式___________________。
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域。某研究小组在实验室探究CoC2O4分解反应的平衡常数。将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:
CoC2O4(S)![]() CoO(S)+CO(g)+CO2(g)
CoO(S)+CO(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度/℃ | 240 | 250 | 260 | 270 |
平衡总压强/kp | 5.7 | 8.3 | 12.0 | 17.1 |
平衡总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
由表中数据,列式计算250℃时CoC2O4分解平衡常数 。 该反应的焓变△H 0(填“>”、“=”或“<”)。
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:试画出CO的体积分数随温度升高的曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能.已知部分化学键的键能如下:
化学键 | N—H | N—N | O=O | N≡N | O—H |
键能(kJ·mol-1) | 386 | 167 | 498 | 946 | 460 |
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态)。1 mol肼完全燃烧时放出的热量为________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液。肼-空气燃料电池放电时,正极的电极反应式是______________________________________。
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构。试推测1个N60的结构含有________个N—N键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
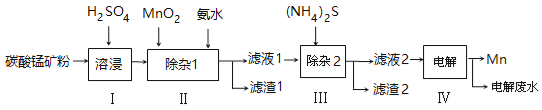
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g)![]() r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是

A. T1>T2,p1>p2,m+n>r,正反应吸热
B. T1<T2,p1<p2,m+n<r,正反应吸热
C. T1>T2,p1>p2,m+n<r,正反应放热
D. T1<T2,p1<p2,m+n>r,正反应放热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com