
����Ŀ�����������ǿ�ѧѧϰ����Ҫ����֮һ������Ԫ�صIJ������ʹ����������£�
|
|
|
|
|
�����۵�/�� | -218,4 | 113 | �� | 450 |
���ʷе�/�� | -183 | 444.6 | 685 | 989 |
��Ҫ���ϼ� | -2 | -2��+4��+6 | -2��+4��+6 | �� |
ԭ�Ӱ뾶/nm | 0.074 | 0.102 | �� | 0.136 |
�������⻯�ϵ����׳̶� | ��ȼʱ���� | ���Ȼ��� | �����ѻ��� | ����ֱ�� |
������ϱ������Լ����ݱ仯���ƣ��ش��������⣺
��1�������۵㷶Χ�����ǣ�________________��
��2���ڣ�Te�����ܵĻ��ϼ��У�___________________��
��3������Se����ԭ�Ӱ뾶������_______________________֮�䡣
��4���ӵ������⻯�ϵ����׳̶ȿ����Ʋ����O��S��Se��Te�ķǽ�������_________(��ǿ������)��
���𰸡���1��113��--450��֮�䣨2��-2,+4��+6��3�� 0.102��0.136֮�䣨4������
���������������������1���ɱ���֪���������ڣ����ʵ��۵������ߣ����������۵㷶Χ������113����450����
��2�������Ļ��ϼ���-2��+4��+6���ڵ������������ƣ������ڵĻ��ϼۿ�����-2��+4��+6��
��3������Se����ԭ�Ӱ뾶����S��Te֮�䣬������Se����ԭ�Ӱ뾶Ϊ0.102��0.136��
��4��������������ӦԽ���ף�Ԫ�صķǽ�����Խǿ���ɷ�Ӧ������֪��O��S��Se��Te�ķǽ�����������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯��������������������ϢϢ��أ��ش��������⣺
��1����̬Nԭ���е�����2p����ϵ��Ų���ѭ��ԭ����__________��ǰ4����Ԫ���У���̬ԭ�Ӻ�������Ų��ɵ�����������Ԫ�صļ۲�����Ų�ʽΪ__________��
��2��C��N��O����Ԫ�ص�һ�����ܴӴ�С��˳����__________��
��3��N2F2������Nԭ�ӵ��ӻ���ʽ��__________��l mol N2F2����__________mol������
��4��NF3�ļ���__________NH3�ļ���(������������������=��)��ԭ����__________.
��5��NH4BF4(�������)�Ǻϳɵ��������ܵ�ԭ��֮һ��l mol NH4BF4__________mol��λ����
��6����ȫ���ҵ����ԭ��Ϊ6NaN3+FeIO3![]() Na2O+2Fe+9N2��
Na2O+2Fe+9N2��
���ȵ������ԭ���ǣ�ԭ��������ͬ���۵���������ͬ�ķ��ӻ����Ӿ������ƵĻ�ѧ������������������������ʣ�д��������N3-��Ϊ�ȵ�����ķ��ӻ�����__________.
��Na2O�ľ����ṹ��ͼ��ʾ��Ʒ���߳�Ϊ566pm����������ԭ�ӵ���λ��Ϊ__________��Na2O������ܶ�Ϊ__________gcm-3(ֻҪ������ʽ�����ؼ�������)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�־���ս������Ľ����������ж��ּ�̬�����ʸ��۵�Ϊ1857 ����
��1����ҵ���Ը��������Ҫ�ɷ���Fe��CrO2��2��Ϊԭ��ұ������������ͼ��ʾ��
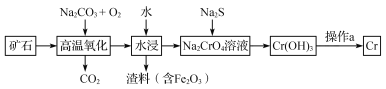
��Fe��CrO2��2�и�Ԫ�ػ��ϼ۾�Ϊ���������Ϊ_______�ۡ�
����������ʱ��Ӧ�Ļ�ѧ����ʽΪ___________________________________��
������a�����־������˻�ѧ��Ӧ�Ĺ��̹��ɵģ������ݷֱ���_______________�����ȷ�Ӧ��
��2��Cr��OH��3���������������д����ֱ���NaOH��ϡ���ᷴӦʱ���ɵ������εĻ�ѧʽ____________________________��
��3����Ԫ�����γɺ����ἰ�������Σ�����ó�ʼŨ��Ϊ1 mol/L�ĸ��� ��H2CrO4�� ��Һ�и��ֺ���Ԫ�ص���Ũ�ȷֱ�Ϊ��c��![]() ��=0.0005 mol��L1��c��
��=0.0005 mol��L1��c��![]() ��=0.1035 mol��L1��c��
��=0.1035 mol��L1��c��![]() ��=a mol��L1����a=______��KHCrO4��Һ��c��OH��___c��H+�������������<����=������
��=a mol��L1����a=______��KHCrO4��Һ��c��OH��___c��H+�������������<����=������
��4��ˮ�еĸ�Ԫ����ˮ�ʼ������������ص������ã������������������
����������![]() ����ˮ����ͨ��Ϊ���������缫�����ˮ��
����ˮ����ͨ��Ϊ���������缫�����ˮ��![]() �����������ɵ����ӻ�ԭ��ΪCr3+�����ɵ�Cr3+�����������ɵ�OH�������Cr��OH��3������ȥ���������ϵĵ缫��ӦʽΪ_________________________����Ҫ������10 mol
�����������ɵ����ӻ�ԭ��ΪCr3+�����ɵ�Cr3+�����������ɵ�OH�������Cr��OH��3������ȥ���������ϵĵ缫��ӦʽΪ_________________________����Ҫ������10 mol ![]() ����ˮ����������Ҫ���ĵ���Ϊ_______g��
����ˮ����������Ҫ���ĵ���Ϊ_______g��
��ת��Ϊ��Ҫ��Ʒ��������������CrxFeyOz��������![]() ����ˮ�м������������ἰ��������������ַ�Ӧ����ͨ��������������������Fe2+��������NaOH���Ϳ���ʹ������Ԫ��ȫ��ת��Ϊ�����������塣д��
����ˮ�м������������ἰ��������������ַ�Ӧ����ͨ��������������������Fe2+��������NaOH���Ϳ���ʹ������Ԫ��ȫ��ת��Ϊ�����������塣д��![]() �����������±�Fe2+��ԭΪCr3+ �����ӷ���ʽ��____________________________________����������1 mol
�����������±�Fe2+��ԭΪCr3+ �����ӷ���ʽ��____________________________________����������1 mol![]() �������������������� ����ˮʱǡ������10 mol FeSO4��������������n��Fe2+����n��Fe3+����3��2ʱ����������Ļ�ѧʽΪ__________��
�������������������� ����ˮʱǡ������10 mol FeSO4��������������n��Fe2+����n��Fe3+����3��2ʱ����������Ļ�ѧʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƶ�һ�֡����������ͳɱ������ͭ����ȼ�ϵ�ء��õ��ͨ��һ�ָ��ӵ�ͭ��ʴ����������������зŵ����Ϊ2Li+Cu2O+H2O��2Cu��2Li++2OH��������˵������ȷ���ǣ� ��

A���ŵ�һ��ʱ����Ҳ�ˮ��ҺpH����
B��������Ӧ�����У�ͭ�൱�ڴ���
C��ͨ����ʱ��ͭ����ʴ���������CuO
D���ŵ�ʱ�������ĵ缫��ӦʽΪCu2O+H2O+2e����2Cu+2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�������嵥�ʵķ�����Ҫ��ˮ����������ȡ���ȡ�ij��ȤС��ͨ���������������������·����Ӹ������Һ������0.27%���л����ӷ���Br2��

��1������X����Ҫ����Ҫ��������Ϊ ��������ʹ��ǰ���©�����鷽��Ϊ ��
��2������ȡʱ����20%��NaOH��Һ�������ӷ���ʽΪ ��
��3������ȡ����ˮ���ữʱ���軺������Ũ���ᣬ�����ñ�ˮԡ��ȴ��ԭ���� ��
��4����Ĵ�ͳ��������Ϊ�Ȳ����������������ÿ���ˮ������Br2�������봫ͳ������ȣ���ȡ�����ŵ��� ��
��5���ҹ���ˮ�����ŷű��涨����ˮ�б��ӵĺ������ó���1.00mg��L�D1��ʵ���ҿ���һ��Ũ�ȵ���ˮ�ⶨij��ˮ�б��ӵĺ�������ԭ�����£�

���������Ӧ��ʵ�鲽�裺
����1��ȷ��ȡ25.00mL�����ˮ��250mL��ƿ�С�
����2����4.5mL 0.02mol��L�D1��ˮѸ�ټ��뵽��ƿ�У�����ƿ������
����3����ƿ��������ƿ�м��������0.1mol��L�D1 KI��Һ����
����4�� ������0.01mol��L�D1 Na2S2O3����Һ�ζ����յ㣬���� Na2S2O3��Һ15mL����Ӧԭ����I2+2Na2S2O3=2NaI+Na2S4O6����
����5����ʵ�鲽��1��4�ظ�2�Ρ�
���÷�ˮ�б��ӵĺ���Ϊ mg��L�D1��
������3������ʱ��ϳ������õķ�ˮ�б��ӵĺ��� ���ƫ�ߡ�����ƫ�͡�����Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ǻ�ѧ�빤ҵ�����ù㷺�����ʡ�

��1����С�����õ��ԭ�����������ͼװ�ý���H2��ԭNO��ʵ��(�����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ������ٱ�Ĥ���缫)�����缫B��____�����ٵ缫A�ĵ缫��ӦʽΪ_____________��
��2������ҵ��ˮ�е�NO2- ��Ũ��ԼΪ1.0��10-4 mol��L-1 ��ȡ��ҵ��ˮ5 mL ���Թ��У��μ�2��0.1 mol��L-1 ����������Һ���ܷ�����������ͨ������˵����(ע��1mL��Һ��20�μƣ�Ksp(AgNO2)=2��10-8)
��3����֪�������ݣ�H-H 436��S=S 255��H-S 339����λkJ/mol��������Ȼ�ѧ����ʽ2H2(g) + S2(g) = 2H2S(g)�Ħ�H=___________
��4����һ���������İ���������������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g)��
2NH3(g)��CO2(g)��
ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶�(��) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ��������Ũ��(��10��3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
���ݱ������ݣ���ʽ����25.0��ʱ�ķֽ�ƽ�ⳣ����__________________________��
��֪��NH2COONH4��2H2O![]() NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��
NH4HCO3��NH3��H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c(NH2COO��)��ʱ��仯������ͼ��ʾ��

����ͼ����Ϣ�����˵��ˮ�ⷴӦ�������¶����߶�����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�����SO2Cl2����һ����ɫҺ�壬��Ҫ�����л����������Ȼ��ȡ����۵�Ϊ-54.1��.�е�Ϊ69.2���������±Ƚ��ȶ��������ֽ⣬��ˮ���ҷ�Ӧ������������ᡣ
��1���Ʊ���ʵ���ҿ�����SO2��Cl2������װ����ȡ����SO2Cl2�����з�������Һ��������ã�����֪SO2(g)+Cl2(g)![]() SO2Cl2(g) ��H��0
SO2Cl2(g) ��H��0
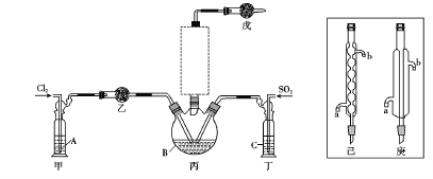
��������Ũ��������Ը��������ȡ�������÷�Ӧ�Ļ�ѧ����ʽΪ ����ҺAΪ ��
����ͼʵ����������������Ϊ ����Ӧװ��ͼ�������δ������������ ����������������������
���������װ�÷����ˮ�У���������ڶ��Ȼ��������ɣ���ԭ���� ��
�������й�˵��������� �����ţ���
a.�ҡ���װ����ͬ����ʵ���е�����Ҳ��ȫ��ͬ
b.�ס���װ��Ϊϴ��װ�ã�����������ij��Ӻ���
c.��װ����������Ҫ���еIJ����Ǽ��װ�õ�������
d.Ϊ��߷�Ӧ��������ʣ��ɿ��Ƽס���װ���в������ݵ��������
��2���ᴿ�����ռ����IJ�����м�ѹ����ѹ�����Ŀ���� ��
��3���ⶨ��ȡ1.00g�����Һ�壬С�ĵ���ȫ����ˮ�������õ���Һ�м��������Ȼ�����Һ��������ɳ���������Ϊ1.60g������������ɷ��ж��Ȼ����������ٷֺ���Ϊ %��
��4�����档���Ȼ���Ӧ���������������ͨ�����õĿⷿ�������ú��Ի�ɫ����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z��T��U���ֶ�����Ԫ�ء�X��Y��Z��Ԫ�������ڱ��е�λ��������ʾ����Ԫ�ص�ԭ������֮����41��X��T�ĵ����ڲ�ͬ�����·�Ӧ����������T2X(��ɫ����)��T2X2(����ɫ����)���ֻ����U������Z������ȼ��ʱ������ɫ���棬�������ˮ��Һ��ʹʯ����Һ��졣
X | |
Y | Z |
��1����Ԫ�صķ����ǣ�Z________��T________
��2��Yԭ�ӵĽṹʾ��ͼΪ____________________,U2X�ĵ���ʽ
��3��YX2��U2Y��Ӧ�Ļ�ѧ����ʽΪ____________________________��������������____________����������Ԫ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����������Ļ����Һ��ȡ��10mL��������BaCl2��Һ�����ˡ�ϴ�ӡ���ɺ�õ�9.32g�ij�������Һ��4.0mol![]() NaOH��Һ��Ӧ����ȥ35mL��Һʱǡ����ȫ�к͡�����
NaOH��Һ��Ӧ����ȥ35mL��Һʱǡ����ȫ�к͡�����
��1�����Һ��H2SO4��HNO3�����ʵ���Ũ�ȸ��Ƕ��٣�
��2����ȡl0mLԭ���Һ������3.2gͭ�۹���ʱ���ڱ�״�����ռ�����������Ϊ����������������λ��Ч���֡���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com