
【题目】CuCl是应用广泛的有机合成催化剂,工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl—)为原料生产CuCl的流程如下:
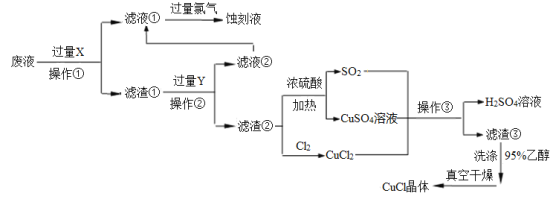
已知:CuCl是一种白色粉末,微溶于水,不溶于乙醇及稀硫酸,在水溶液中存在平衡:
CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
[CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
根据以上信息回答下列问题:
(1)试剂X是______,检验刻蚀液中金属阳离子的化学试剂是_____。(均填化学式)
(2)操作①、②、③相同,名称是________,所需要的主要玻璃仪器有烧杯、___ 、_____。
(3)滤渣①与Y反应的离子方程式为_________________。
(4)产生CuCl的化学方程式为_______________,当观察到 现象,即表明反应已经完全。
(5)在操作③之前往往向反应后的溶液中加入大量的水,其作用是 。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_________。
【答案】
(1)Fe(1分) KSCN(或其他合理答案) (1分)
(2)过滤(1分) 玻璃棒、漏斗(2分)
(3)Fe+2H+=Fe2++H2↑(2分)
(4)CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4(3分) 溶液由蓝色变为无色(1分)
(5)稀释,促进平衡CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液)逆向移动,生成CuCl(2分)
[CuCl3]2-(无色溶液)逆向移动,生成CuCl(2分)
(6)防止CuCl的氧化和见光分解(2分)
【解析】
试题分析:向工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl—)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁的活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,硫酸铜、二氧化硫、氯化铜反应生成氯化亚铜;
(1)印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)加入铁,三价铁离子能够原铁反应生成二价铁离子,铜离子能够与铁反应生成铜,过滤后滤渣中含有铜和铁,加入盐酸,铁与盐酸反应生成氯化亚铁,铜与盐酸不反应,将铜分离出来;氯化亚铁溶液中通入氯气生成氯化铁,检验铁离子的试剂是KSCN溶液;
(2)操作①、②、③均是过滤,所需要的主要玻璃仪器有烧杯、玻璃棒和漏斗。
(3)滤渣①与盐酸反应的离子方程式为Fe+2H+=Fe2++H2↑。
(4)依据图示可知:CuCl2、CuSO4、SO2、H2O反应生成H2SO4、CuCl,产生CuCl的化学方程式依据得失电子守恒得到CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4,硫酸铜溶液是蓝色的,所以当观察到溶液由蓝色变为无色时即表明反应已经完全。
(5)因为CuCl在水溶液中存在平衡:CuCl(白色)+ 2Cl-![]() [CuCl3]2-(无色溶液),加水稀释,使平衡逆向移动,从而生成CuCl沉淀。
[CuCl3]2-(无色溶液),加水稀释,使平衡逆向移动,从而生成CuCl沉淀。
(6)氯化亚铜具有还原性,易被氧化而变质,见光易分解,所以生产中应防止CuCl的氧化和见光分解,减少产品CuCl的损失。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2;
②单位时间内生成n molO2的同时生成2n mol NO;
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体中![]() 不变;
不变;
⑤混合气体的颜色不再改变的状态;
⑥混合气体的密度不再改变的状态;
⑦混合气体的平均相对分子质量不再改变的状态.
A. ①⑤⑥ B. ①④⑤⑦ C. ①⑤⑥⑦ D. ①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究金属铜与一定物质的量浓度的HNO3反应,将制得的气体通过浓硫酸后被完全吸收,由此做出猜想:①NO2溶于浓硫酸或与浓硫酸反应;②NO溶于浓硫酸或与浓硫酸反应,并进行下列实验:
实验一:将制得的纯净的NO2通入浓硫酸中,溶液变成棕黄色,加热浓硫酸,气体逸出,溶液颜色褪去;
实验二:将制得的纯净的NO通过浓硫酸后用排水集气法收集到足量无色气体,通入氧气后气体变成红棕色;
(1)由此得出的结论是___________________。
(2)查阅资料得知:NO、NO2等体积通入浓硫酸中反应生成NOHSO4(其中氮化合价为+3价),气体被全部吸收,试写出此反应的化学方程式_____________________。
(3)为制得干燥的NO2,可将湿润的NO2通过________干燥。也可用Pb(NO3)2加热得含有NO2
的混合气体,并用冰盐水冷却后可得到纯净的液态N02 , 己知Pb(NO3)2受热分解的产物中有PbO ,试写出加热Pb(NO3)2反应的方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:
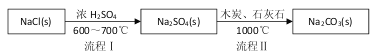
(1)流程I的另一产物是____,流程Ⅱ的反应分步进行:a. ![]()
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为__________________。
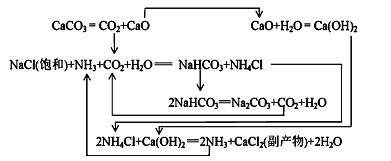
Ⅱ.1862年,比利时人索尔维(ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:
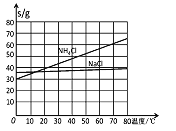
20℃时一些物质在水中的溶解度/g(100gH2O)
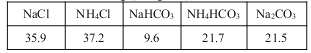
(2)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________。
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:_________、__________、_________。
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率。
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在________(填温度范围)下析出________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 。
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60mL0.50mol·L-1的盐酸跟60mL0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
(5)用相同浓度体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会_____(均填“偏大”“偏小”“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢被称为绿色氧化剂,它的分子结构如下图所示。已知该分子H-O-O键角都是97°。下列有关H2O2的说法正确的是
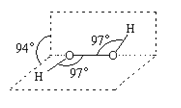
A.过氧化氢分子中存在离子键、共价键
B.在1.00mol H2O2中,核外电子总数为10×6.02×1023个
C.过氧化氢既有氧化性又有还原性
D.3.4g过氧化氢中含有6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)39H2O]的流程如图甲:
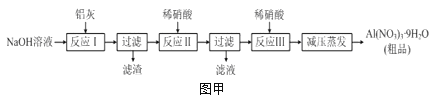
(1)写出反应Ⅰ的离子方程式:______________________________________________。
(2)若用图乙所示实验装置制取Al(NO3)3,通入水蒸气的作用是__________________。
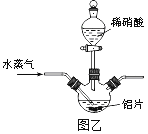
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是__________。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和某气体。已知:2NO2+2NaOH=NaNO2+NaNO3。为了确定生成气体的成分,某学生拟用下列装置进行实验。
①进行实验时装置接口正确顺序是A→________________________→F。
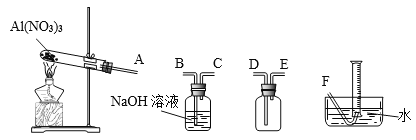
②证明分解生成的混合气体中有NO2的现象是_____________________。
③取21.3g Al(NO3)3加热分解,用排水法收集气体,最终在标准状况下收集到_____mL气体,结合化学方程式说明理由____________________________。
(5)设计实验证明粗品中含有Al(NO3)3:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是8种有机化合物的转换关系:
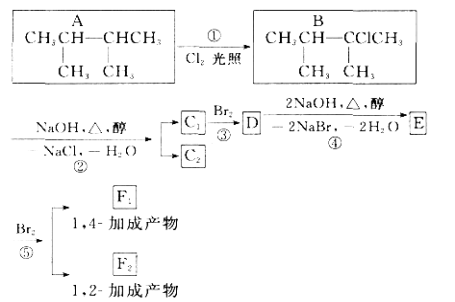
请回答下列问题:
(1)上述框图中,①是________反应,③是________反应(填反应类型)。
(2)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______________________________________________________________。
(3) C 1的结构简式是______________________;F 1的结构简式是_____________________________。
(4) 上述8种化合物中,属于二烯烃的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为浓硫酸与铜片反应的装置。请回答:
(1)浓硫酸与铜片反应的化学方程式为 。

(2)反应一段时间后,试管乙中品红溶液的现象是 。
(3)下列有关该实验的说法中,不正确的是 。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com