
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
Ⅰ.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:
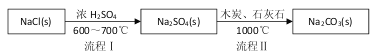
(1)流程I的另一产物是____,流程Ⅱ的反应分步进行:a. ![]()
b.Na2S与石灰石发生复分解反应,总反应方程式可表示为__________________。
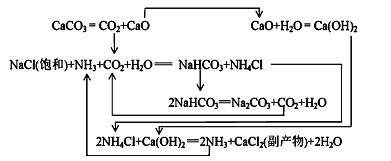
Ⅱ.1862年,比利时人索尔维(ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:
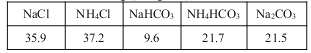
20℃时一些物质在水中的溶解度/g(100gH2O)
(2)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________。
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3的原因有:_________、__________、_________。
Ⅲ.我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率。
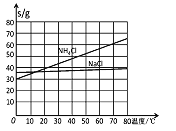
(4)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在________(填温度范围)下析出________(填化学式)。
【答案】(1)HCl;Na2SO4+4C +CaCO3 ![]() Na2CO3+CaS+4CO↑;
Na2CO3+CaS+4CO↑;
(2)食盐、石灰石、NH3; CaO、CO2、NH4Cl (多答Ca(OH)2和NH3不扣分)
(3)反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大;(4) 0~10℃;NH4Cl;
【解析】
试题分析:(1)流程I中氯化钠与浓硫酸在加热时反应生成硫酸钠和氯化氢,流程Ⅱ的反应分步进行:a. ![]() b.Na2S与石灰石发生复分解反应,反应的总反应方程式为Na2SO4+4C +CaCO3
b.Na2S与石灰石发生复分解反应,反应的总反应方程式为Na2SO4+4C +CaCO3 ![]() Na2CO3+CaS+4CO↑,故答案为:HCl;Na2SO4+4C +CaCO3
Na2CO3+CaS+4CO↑,故答案为:HCl;Na2SO4+4C +CaCO3 ![]() Na2CO3+CaS+4CO↑;
Na2CO3+CaS+4CO↑;
(2)根据流程图,氨碱法生成纯碱的原料有食盐、石灰石、NH3;,可循环利用的物质有CaO、CO2、NH4Cl,故答案为:食盐、石灰石、NH3; CaO、CO2、NH4Cl;
(3)饱和NaCl溶液通NH3和CO2能生成NaHCO3是因为反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大,故答案为:反应体系中NaHCO3溶解度最小,反应消耗水,NaHCO3相对分子质量最大;
(4)根据溶解度曲线,生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在0~10℃下析出氯化铵晶体,故答案为:0~10℃;NH4Cl。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下表列出了A~H 8种元素在周期表中的位置:

(1)8 种元素中化学性质最不活泼的是_________(填元素符号);
(2)元素E、F的最高价氧化物对应的水化物反应的离子方程式为______________;
(3)元素D的最低价的氢化物与单质G发生反应的化学方程式为_______________;
(4)写出元素A、C形成的化学式为CA5的电子式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池由A、B、C、D四种金属按下表中装置图进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________。
(2)装置乙中正极的电极反应式是________________________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
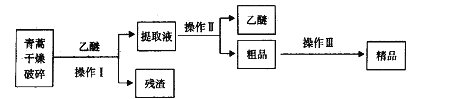
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、___________,操作Ⅱ的名称是_________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是____________,装置F中盛放的物质是______________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
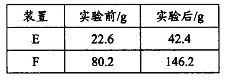
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
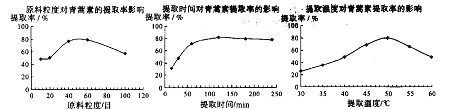
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)下图是实验室用氢气还原氧化铜实验的简易装置。其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中。
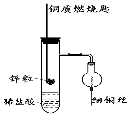

(1)铜质燃烧匙的作用有 , 。
(2)实验过程中,在试管M中可观察到的现象是 , 。
(二)原电池与电解池在化学工业中有广泛应用。如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
(1)若断开k1,闭合k2,则装置为_____ ;X电极上的电极反应式为_____________;电解质溶液中的阳离子向______极移动(填X或Y);
(2)若线路中通过3.01×1022的电子,则Y极上析出物质的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl—)为原料生产CuCl的流程如下:
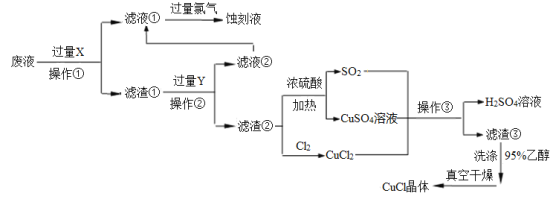
已知:CuCl是一种白色粉末,微溶于水,不溶于乙醇及稀硫酸,在水溶液中存在平衡:
CuCl(白色)+2Cl-![]() [CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
[CuCl3]2-(无色溶液);在空气中迅速被氧化成绿色;见光则分解,变成褐色。
根据以上信息回答下列问题:
(1)试剂X是______,检验刻蚀液中金属阳离子的化学试剂是_____。(均填化学式)
(2)操作①、②、③相同,名称是________,所需要的主要玻璃仪器有烧杯、___ 、_____。
(3)滤渣①与Y反应的离子方程式为_________________。
(4)产生CuCl的化学方程式为_______________,当观察到 现象,即表明反应已经完全。
(5)在操作③之前往往向反应后的溶液中加入大量的水,其作用是 。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2化学与技术】将“废杂铜烟尘”用硫酸吸收浸取,既可保护环境又可得到用途广泛的高纯硫酸锌。已知烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO、PbO、CdO。制备工艺流程如下:
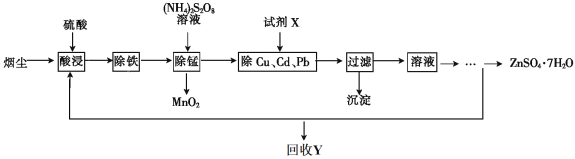
已知:相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Zn2+ | 5.5 | 8.0 |
Fe2+ | 5.8 | 8.8 |
(1)回收的产品Y是_____________________。
(2)“除铁”时,先加入_________________(氧化剂、还原剂),再将溶液的pH调整到__________。
(3)“除锰”时溶液中发生反应的化学方程式为____________________。
(4)除去Cu、Cd、Pb的同时可以回收一些重金属,试剂X为__________________。
(5)ZnSO4溶液经过__________、__________、过滤及干燥得到ZnSO4·7H2O。
(6)为了测定产品中ZnSO4·7H2O的含量,取ag产品溶于水,向所得溶液中慢慢加入碳酸钠溶液至沉淀完全;过滤、洗涤沉淀,在将沉淀固体煅烧至完全分解,称得为bg,则产品中ZnSO4·7H2O的质量分数是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:

已知:FeTiO3+4H+=Fe2++TiO2++2H2O,草酸(H2C2O4)具有很强还原性,易被氧化成二氧化碳。
(1)化合物FeTiO3中铁元素的化合价是 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为______ _________(填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为 (用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:![]()
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是___ ____。由TiCl4→Ti需要在Ar气中进行的理由是___ _______。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于 ℃即可。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com