
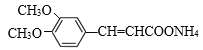
【题目】有机物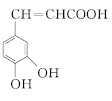 是一种重要的有机合成中间体,其合成路线如下:
是一种重要的有机合成中间体,其合成路线如下:
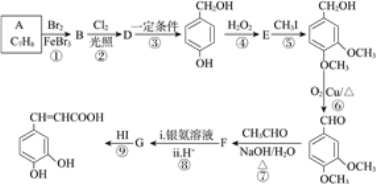
已知:①B的核磁共振氢谱有三个吸收峰;
②![]()
![]()
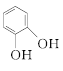 ;
;
③
![]()
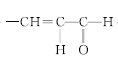 +H2O 。
+H2O 。
(1)B的名称为____________。
(2)反应⑤的反应类型为__________。G的结构简式为_______________。
(3)在合成路线中设计⑤和⑨两步反应的目的是________________。
(4)反应⑥的化学方程式为__________________。
(5)F与银氨溶液反应的化学方程式为________________。
(6)M为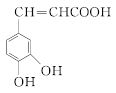 的同分异构体,满足下列条件的M的结构有________种。任写一种核磁共振氢谱有4组峰的M的结构简式_________________。
的同分异构体,满足下列条件的M的结构有________种。任写一种核磁共振氢谱有4组峰的M的结构简式_________________。
a.属于芳香族化合物 b.1 mol M与足量NaHCO3溶液反应能生成2 mol CO2
(7)参照上述合成路线,以乙醇为原料(其他无机试剂任选),设计制备正丁醇的合成路线_____________。
【答案】对溴甲苯或4-溴甲苯 取代反应 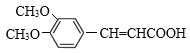 保护酚羟基 2
保护酚羟基 2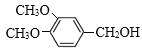 +O2
+O2![]() 2
2 +2H2O
+2H2O 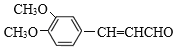 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
 +2Ag↓+3NH3+H2O 10
+2Ag↓+3NH3+H2O 10 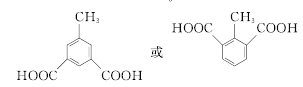 CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
【解析】
A的分子式是C7H8,根据物质反应过程中分子骨架不变,可知A是甲苯![]() ,A与Br2在FeBr3作用下发生苯环上的取代反应产生B:
,A与Br2在FeBr3作用下发生苯环上的取代反应产生B:![]() ,
,![]() 在在光照时与Cl2发生甲基上的取代反应产生D:
在在光照时与Cl2发生甲基上的取代反应产生D:![]() ,该物质在一定条件下反应产生
,该物质在一定条件下反应产生![]() ,
,![]() 被H2O2氧化产生E:
被H2O2氧化产生E: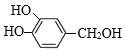 ,
, 与CH3I发生取代反应产生
与CH3I发生取代反应产生 ,该物质含有醇羟基,与O2在Cu催化下加热,发生氧化反应产生
,该物质含有醇羟基,与O2在Cu催化下加热,发生氧化反应产生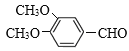 ,
, 与CH3CHO在NaOH水溶液中加热,反应产生F:
与CH3CHO在NaOH水溶液中加热,反应产生F: ,F含有醛基,与银氨溶液发生银镜反应,然后酸化可得G:
,F含有醛基,与银氨溶液发生银镜反应,然后酸化可得G: ,G与HI反应产生
,G与HI反应产生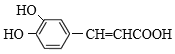 。
。
(7)乙醇催化氧化产生乙醛:CH3CHO,乙醛在NaOH水溶液中加热反应产生CH3CH=CH-CHO,CH3CH=CH-CHO与H2在催化剂存在时加热,发生加成反应产生丁醇CH3CH2CH2CH2OH。
根据上述分析可知,B为![]() 、D为
、D为![]() 、E为
、E为 、F为
、F为 、G为
、G为 。
。
(1)B的结构简式为![]() ,B的名称是对溴甲苯或4-溴甲苯。
,B的名称是对溴甲苯或4-溴甲苯。
(2)反应⑤是 与CH3I发生取代反应产生
与CH3I发生取代反应产生 和HI,该反应类型为取代反应;物质G的结构简式为
和HI,该反应类型为取代反应;物质G的结构简式为 。
。
(3)在合成路线中设计⑤使酚-OH变为-OCH3,在反应⑨中又使-OCH3转化为酚-OH,设计两步反应的目的是保护酚羟基在后续步骤中不被氧化。
(4)反应⑥是醇羟基被氧化为醛基,该反应的化学方程式为2 +O2
+O2![]() 2
2 +2H2O。
+2H2O。
(5)F与银氨溶液反应的化学方程式为 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
 +2Ag↓+3NH3+H2O。
+2Ag↓+3NH3+H2O。
(6)满足条件的M的同分异构体有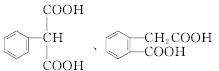 (邻、间、对位3种)、
(邻、间、对位3种)、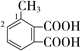 (甲基在1、2位置2种)、
(甲基在1、2位置2种)、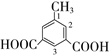 (甲基在1、2、3位置3种)、
(甲基在1、2、3位置3种)、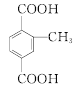 ,共10种;其中核磁共振氢谱有4组峰的结构简式为
,共10种;其中核磁共振氢谱有4组峰的结构简式为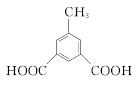 或
或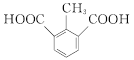 。
。
(7)乙醇催化氧化产生CH3CHO,乙醛在NaOH水溶液中加热反应产生CH3CH=CH-CHO,CH3CH=CH-CHO与H2在催化剂存在时加热,发生加成反应产生丁醇CH3CH2CH2CH2OH,所以由乙醇制取丁醇的合成路线为 CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH。
CH3CH2CH2CH2OH。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O ![]() ZnO+2Ni(OH)2。下列说法错误的是
ZnO+2Ni(OH)2。下列说法错误的是

A.放电过程中OH通过隔膜从负极区移向正极区
B.充电时阳极反应为Ni(OH)2+OHe=NiOOH+H2O
C.放电时负极反应为Zn+2OH2e=ZnO+H2O
D.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.![]() 点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
点溶液中存在如下关系:c(Na+)+ c(H+)=c(ClO-) +c(ClO3-) +c(OH-)
C.![]() 点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
点溶液中各离子浓度:c(Na+)> c(Cl-) >c(ClO3-) =c(ClO-)> c(OH-) >c(H+)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2 ClO-=Cl-+ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的常见化合价与原子序数的关系图:
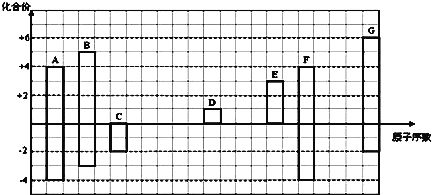
注:答题时,A—G所有元素都用其对应的元素符号表示。
(1)画出A的原子结构示意图______________;
(2)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物(H的稳定氧化物为液态)时放出的热量为QkJ,请写出表示1molA2H6完全燃烧的热化学方程式:_____________;
(3)用电子式表示D2G的形成过程______________;其所含化学键类型为________;
(4)C2-、D+、G2-离子半径大小顺序是___>____>____;
(5)C、G元素所形成的氢化物稳定性为___>____(填化学式),原因是:______________;
(6)某同学设计实验证明A、B、F的非金属性强弱关系, 装置如图。
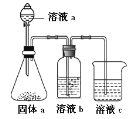
①溶液a和b分别为_________,__________;
②溶液c中发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
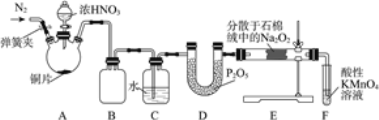
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
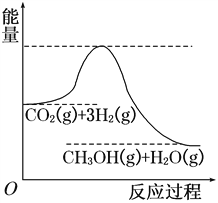
(1)上述反应平衡常数K的表达式为________________,温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)=________。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是________(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
Ⅱ、(1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,如图所示(T1、T2均大于300℃)
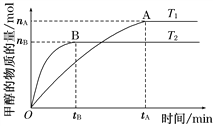
下列说法正确的是________(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是非常重要的能源和化工原料,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1,写出CH4还原NO2至N2的热化学方程式:_____。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒镀铜。
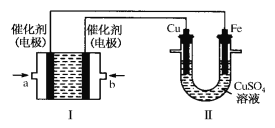
①a处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是 ___________。
②电镀结束后,装置Ⅱ中Cu2+的物质的量浓度____(填写“变大”“变小”或“不变”)。
③若实验过程中Ⅱ中的铜片质量减少了1.28g,则Ⅰ中理论上消耗CH4的体积(标准状况)__ _L。
(3)若将题(2)装置Ⅱ中的两电极均改为石墨惰性电极,电解质溶液仍为CuSO4溶液。
①写出装置Ⅱ中发生的总化学反应方程式_________。
②电解硫酸铜溶液一段时间后,装置Ⅱ中溶液的pH____(填写“变大”“变小”或“不变”);要使原溶液复原,可向电解后的溶液中加入_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Deacon发明将氯化氢直接转化为氯气:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH。下图为恒容密闭容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系。下列说法正确的是
2Cl2(g)+2H2O(g) ΔH。下图为恒容密闭容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时,HCl平衡转化率随温度变化的关系。下列说法正确的是
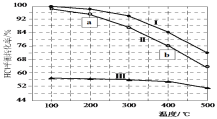
A.ΔH> 0
B.正反应速率v正(a)<v正(b)
C.曲线Ⅲ进料浓度比c(HCl)∶c(O2)等于1:1
D.若HCl初始浓度为c0,按曲线Ⅰ计算K(400℃),表达式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com