
【题目】下列不能说明氯元素的非金属性比硫元素强的是( )
A.氧化性:![]()
B.![]()
C.气态氢化物的稳定性:![]()
D.![]() 与
与![]() 反应生成
反应生成![]() ,而
,而![]() 与
与![]() 生成
生成![]()
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min
D. 当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
A. 萃取、过滤、蒸馏、蒸馏 B. 过滤、分液、蒸馏、萃取
C. 过滤、蒸馏、过滤、蒸馏 D. 过滤、分液、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应限度的说法错误的是
A.可逆反应达到反应限度之前,正反应速率与逆反应速率一定不相等,但各物质的浓度可能相等
B.可逆反应的化学反应限度不会随反应条件的改变而改变
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.一定条件下,炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于![]() 的
的![]() 溶液的叙述正确的是( )
溶液的叙述正确的是( )
A.该溶液中由![]() 电离出的
电离出的![]()
B.与等体积![]() 的
的![]() 溶液混合,所得溶液呈中性
溶液混合,所得溶液呈中性
C.该溶液中离子浓度大小关系:![]()
D.滴加![]() 溶液至
溶液至![]() 时,溶液
时,溶液![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素,如图是实验室从海藻中提取捵的部分流程:

下列判断不正确的是
A.步骤①、③的操作分别是过滤、萃取分液
B.步骤②中反应的离子方程式为:![]()
C.可用淀粉溶液检验步骤②中的反应是否进行完全
D.步骤③中加入的有机溶剂可以是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N(均为气体)的物质的量随反应时间变化的曲线如图,如图所示:

(1)该反应的化学方程式是__________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,t2时刻V(生成M)____V(消耗M)(填>、<或=);
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的一组是( )
A.由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2 g H2,则电路通过电子0.4NA
B.18 g D2O中含有的质子数目为10NA
C.在标准状况下,22.4L正戊烷的所含的原子数为17NA
D.常温常压下,16 g O3所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )


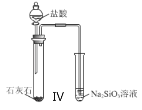
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:湿润的有色布条能褪色,烧杯NaOH溶液的作用是吸收尾气
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:用该装置可以验证酸性:盐酸>碳酸>硅酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com