
| A. | 硅酸可使紫色石蕊试液变红色 | |
| B. | 二氧化硫通入紫色石蕊试液中.试液先变红后褪色 | |
| C. | 可用锌粒与稀硝酸反应制备氢气 | |
| D. | 液溴易挥发,所以存放液溴的试剂瓶中应加水封保存 |
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑤ | C. | ①②④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入CuSO4溶液中:2Na+Cu2+═2Na++Cu | |
| B. | 过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Mg(OH)2悬浊液中滴加四滴0.1mol•L-1FeCl3溶液:3Mg(OH)2(S)+2Fe3+(aq)═2Fe(OH)3(S)+3Mg2+(aq) | |
| D. | 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
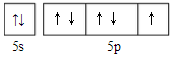 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有脱水性,因此实验室可用浓硫酸与浓盐酸制取少量HCl气体 | |
| B. | 钠是活泼金属,可用电解NaCl溶液的方法获得金属钠 | |
| C. | 碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污 | |
| D. | 在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Ⅰ、Ⅱ装置之间缺少干燥装置 | B. | Ⅱ装置中玻璃管内有水冷凝 | ||
| C. | Ⅱ装置中CuO没有全部被还原 | D. | Ⅲ装置后缺少干燥装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com