
| A. | ①②⑥ | B. | ③④⑤ | C. | ①②④⑤ | D. | ②③⑤ |
分析 H2、CO在整个过程中发生的化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、2Na2O2+2H2O=4NaOH+O2↑;2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、2Na2O2+2CO2=2Na2 CO3+O2,由反应方程式可知,过氧化钠增加的质量即为H2、CO的质量.因此只要是CO或H2或它们的混合气体或化学组成符合(CO)m•(H2)n满足题意.
解答 解:H2、CO在整个过程中发生的化学方程式为:
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O 2Na2O2+2H2O=4NaOH+O2↑;
2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 2Na2O2+2CO2=2Na2 CO3+O2,
由反应方程式可知,过氧化钠增加的质量即为H2、CO的质量.因此只要是CO或H2或它们的气体或化学组成符合(CO)m•(H2)n,则过氧化钠固体增重质量等于原物质的质量,则①②符合,而④HCHO可以改写成CO•H2,⑤CH3COOH可以改写成(CO)2•(H2)2,⑥HCOOH可以改写成CO2•H2,故④⑤符合,⑥不符合,
所以符合此要求的是①②④⑤;
故选C.
点评 本题考查化学方程式的有关计算,注意根据方程式利用差量法进行解答,侧重考查学生分析解决问题的能力,难度中等.


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO-2、SO2-4 | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 镍镉可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2$?_{放电}^{充电}$Cd(OH)2+2Ni(OH)2+2H2O,充电时阳极反应为:Ni(OH)2+OH-+e-═NiO(OH)+H2O | |
| D. | 某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O.已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①③④⑤⑥ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

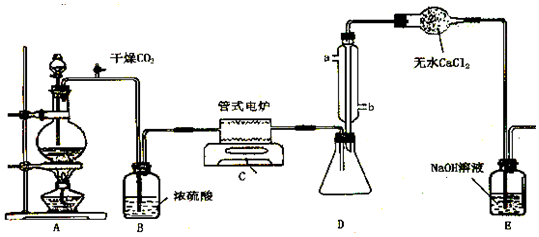
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
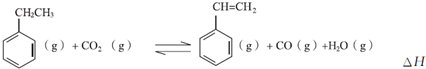
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1 NaAlO2溶液中AlO2-数为0.1NA | |
| B. | 4.48L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 1.2g金刚石所含共价键数为0.2NA | |
| D. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是SO3气体 |
| B | 向某溶液中加入Cu 和浓H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有NO3- |
| C | 将Na投到一定浓度的CuCl2溶液 | 出现气泡并有固体生成 | Na与CuCl2溶液反应,有H2和Cu生成 |
| D | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸可使紫色石蕊试液变红色 | |
| B. | 二氧化硫通入紫色石蕊试液中.试液先变红后褪色 | |
| C. | 可用锌粒与稀硝酸反应制备氢气 | |
| D. | 液溴易挥发,所以存放液溴的试剂瓶中应加水封保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com