
����Ŀ���Թ��ȸʯ[��Ҫ�ɷ�Ϊ CuCO3Cu��OH��2��CuSiO32H2O���� SiO2��FeCO3��Fe2O3������]Ϊԭ���Ʊ�CuCl2�Ĺ����������£� 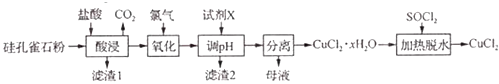
��֪��SOCl2+H2O ![]() SO2��+2HCl��
SO2��+2HCl��
��1���������ʱ������CuCO3Cu��OH��2��Ӧ�Ļ�ѧ����ʽΪ �� Ϊ��ߡ������ʱͭԪ�صĽ����ʣ����Բ�ȡ�Ĵ�ʩ�У����ʵ��������Ũ�ȣ����ʵ���߷�Ӧ�¶ȣ��� ��
��2������2����Ҫ�ɷ�Ϊ���ѧʽ����
��3����������ʱ������Ӧ�����ӷ���ʽΪ ��
��4���Լ�X�������ǵ�����Һ��PH���Լ�X������
A��CuSO4 B��Cu2��OH��2CO3 C��NaOH D��CuO
����pH��ʱ��PH���ܹ��ߣ���ԭ���� ��
��5����������ˮ��ʱ������SOCl2��Ŀ���� ��
���𰸡�
��1��CuCO3?Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O���ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ��
��2��Fe��OH��3
��3��Cl2+2Fe2+�T2Fe3++2Cl��
��4��BD����ֹCu2+ת��ΪCu��OH��2����
��5�����ɵ�HCl����CuCl2��ˮ��
���������⣺��1���������ʱ������CuCO3Cu��OH��2��ӦΪ���ֽⷴӦ���ɴ�ȷ��������ƽ�û�ѧ����ʽΪCuCO3Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O��Ϊ��ߡ������ʱͭԪ�صĽ����ʣ��ɣ����ʵ��������Ũ�ȣ����ʵ���߷�Ӧ�¶ȣ����ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ�䣬
���Դ��ǣ�CuCO3Cu��OH��2+4HCl�T2CuCl2+CO2��+3H2O���ʵ��ӿ�������ʡ��ʵ��ӳ����ʱ�䣻
��2.����������ͼ������������Һ����������ҪΪCu2+��Fe3+ �� ���Լ�X����pHʹFe3+��ȫ��������ȥ������2ΪFe��OH��3 ��
���Դ��ǣ�Fe��OH��3��
��3.�����ȸʯ��Ҫ�ɷ�ΪCuCO3Cu��OH��2��CuSiO32H2O����SiO2��FeCO3��Fe2O3�����ʣ���������ͼ�������ᡰ���������Һ��ֻ��Fe2+�ɱ�������������������ʱ������Ӧ�����ӷ���ʽΪCl2+2Fe2+�T2Fe3++2Cl�� ��
���Դ��ǣ�Cl2+2Fe2+�T2Fe3++2Cl����
��4.����������ͼ������������Һ����������ҪΪCu2+��Fe3+ �� ���Լ�X����pHʹFe3+��ȫ��������ȥ��Cu2+��������Һ�У�ʵ��Cu2+��Fe3+�ķ��룬�����Ʊ�CuCl2���Լ�Xѡ��
A��CuSO4 ���ܵ�����ҺPH������������������ӣ���A����
B��Cu2��OH��2CO3 ���ᷴӦ���Ե�����ҺPH�Ҳ��������ʣ���B��ȷ��
C��NaOH���Ե�����ҺPH�������������������ʣ���C����
D��CuO���Ժ��ᷴӦ������ҺPH�������������ʣ���D��ȷ��
ѡBD
����pH��ʱ��pH���ܹ��ߣ�����Cu2+ת��ΪCu��OH��2������
���Դ��ǣ�BD����ֹCu2+ת��ΪCu��OH��2��������5������֪��SOCl2+H2O ![]() SO2��+2HCl������������ˮ��ʱ������SOCl2��Ŀ�������ɵ�HCl����CuCl2��ˮ�⣬
SO2��+2HCl������������ˮ��ʱ������SOCl2��Ŀ�������ɵ�HCl����CuCl2��ˮ�⣬
���Դ��ǣ����ɵ�HCl����CuCl2��ˮ�⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ݸ�Ŀ���м��أ����վƷǹŷ�Ҳ����Ԫʱʼ���䷨����Ũ�ƺ�����굣��������ϣ�������ȡ��¶���������漰�IJ���������
A.����B.����C.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�������̶�������������������ƶ���M��N���������о�������Ӧ��
N2��g��+3H2��g��2NH3��g����H=��192kJmol��1 �� �� M��N �У���ͨ�� xmol N2 ��ymol H2�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ���ǣ� ��![]()
A.��x��y=1��2����ƽ��ʱ��M�е�ת���ʣ�N2��H2
B.��x��y=1��3����M�зų�����172.8kJʱ��N2��ת����Ϊ90%
C.��x=1��y=3����ﵽƽ��ʱ��Ӧ���ת����N��M
D.ƽ��ʱN2����������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�����ú�������ʣ������Ȱ�úת��ΪCO��H2���ٽ�����ת��Ϊ�״���ijʵ����Ա��һ���¶��µ��ܱ������У�����һ������H2��CO��������Ӧ:
2H2(g)+CO(g)![]() CH3OH(g)���ⶨ�IJ���ʵ����������:
CH3OH(g)���ⶨ�IJ���ʵ����������:
t/s | 0 | 500 | 1 000 |
c(H2)/(mol��L-1) | 5.00 | 3.52 | 2.48 |
c(CO)/(mol��L-1) | 2.50 |
(1)��500 s����H2��ʾ�Ļ�ѧ��Ӧ��������������
(2)��1 000 s����CO��ʾ�Ļ�ѧ��Ӧ��������������1 000 sʱCO��ת��������������
(3)��500 sʱ���ɵļ״���Ũ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ֻ���ƻ����Ӽ�����
A.������ۻ�B.������C.����NaClD.HCl(g)����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������л������( )
���Ҵ� �ڵ����� ��ʯī �ܼ��� ������ ��̼�� ��һ����̼ ��̼��� ������
A.�٢ܢݢߢ��B.�٢ܢݢ�C.�٢ڢܢݢ�D.�٢ڢ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯����������ͼ��ʾ����������ȷ����

A. ��Ӧ��ʼ��10s����Z��ʾ�ķ�Ӧ����Ϊ0.158 mol/(Ls)
B. ��Ӧ��ʼ��10s��X�����ʵ���Ũ�ȼ�����0.79 mol/L
C. ��Ӧ��ʼ��10s��Y��ת����Ϊ79.0 %
D. ��Ӧ�Ļ�ѧ����ʽΪ��X��Y![]() Z
Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�綯����ʹ�õ��Ǹ�����أ����ܷ�ӦΪ3Zn��OH��2+2Fe��OH��3+4KOH ![]() 3Zn+2K2FeO4+8H2O������˵����ȷ���ǣ� ��
3Zn+2K2FeO4+8H2O������˵����ȷ���ǣ� ��
A.�ŵ�ʱ������6mol���ӷ���ת�ƣ�����2mol K2FeO4������
B.�ŵ�ʱ��������ӦΪ��FeO42��+4H2O+3e���TFe��OH��3+5OH��
C.���ʱ����صĸ�������ӵ�Դ����������
D.���ʱ������������Һ��pH��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com