
【题目】我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________。
(2)根据下表Cr原子的能级电离能(I:k]/mo1)数据,解释原子逐级电离能增大的原因:_______。
I1 | I2 | I3 | I4 | I5 | I6 | I7 |
652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____,N的杂化方式为________,写出NH3的一种等电子体___________。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________。
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.NaB.PoC.MgD.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏加德罗常数用NA表示,则Cr的原子半径是__pm.(写出表达式即可)
【答案】 3d54s1 K、Cu 随着电子的逐个失去,阳离子所带的正电荷数越来越大,再失去一个电子需要克服的电性引力也越来越大,消耗的能量也越来越多 Cr(H2O)6Cl3 四面体形 sp3 PH3 乙醇能形成分子间氢键 A 8 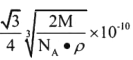
【解析】(1)Cr的原子序数为24,核外电子排布式为:1S22S22P63S2P63d54S1,其外围电子排布式3d54s1。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是K和 Cu。
(2)因为随着电子的逐个失去,阳离子所带的正电荷数越来越大,再失去一个电子需要克服的电性引力也越来越大,消耗的能量也越来越多。所以表中Cr原子的电离能逐级增大。
(3)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的为 [Cr(H2O)4C12]Cl·6H2O和紫色的Cr(H2O)6Cl3,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,因为NH3的中心原子上有1对孤对电子,加上中心原子上的σ键电子对,它们的中心原子上的价层电子电子对数都是4,这些价层电子相互排斥,形成了正四面体型结构。所以NH3的VSEPR模型为四面体形,N的杂化方式为sp3。因为等电子体是指原子总数相等,价电子总数相同的分子,具有相似的化学性质,所以NH3的等电子体为PH3。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但因为乙醇与水能形成分子间氢键,所以乙醇的沸点比乙醛高。答案:乙醇能形成分子间氢键。
(5)①因为体心立方堆积是指晶胞中含有两个原子的立方体,一个原子在立方体的顶点上,另一个原子在立方体的中心。Cr晶体的堆积模型是体心立方堆积。而碱金属也属于这种堆积,所以Na 属于体心立方堆积。Po属于简单立方堆积,Mg属于六方最紧密堆积,Cu属于面心立方最紧密堆积,故选A.
②晶胞中配位数是指与指定原子接触的原子的数目。Cr属于体心立方堆积的晶胞,中心Cr原子与立方体顶点的8个Cr原子距离都相同,所以晶胞中Cr的配位数为8。答案:8。
③因为Cr属于体心立方堆积的晶胞,所以每个晶胞中含有两个Cr原子。设晶胞的边长为a pm,根据公式p=m/v=2M/[NA.(.a![]() 10-10)3],所以a=
10-10)3],所以a=![]()
![]() 10-10 ,根据晶胞的结构为体心立方堆积,所以Cr的原子半径为
10-10 ,根据晶胞的结构为体心立方堆积,所以Cr的原子半径为 。
。


科目:高中化学 来源: 题型:
【题目】在规定范围内使用食品添加剂,一般认为对人体健康无害,如果违反规定,均会损害人体健康。下列物质可用作食品防腐剂的是
A. 甲醛 B. 维生素E C. 柠檬酸 D. 苯甲酸及其钠盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组采用以下装置进行铁粉和水蒸气的实验,并对反应后的产物进行探究.
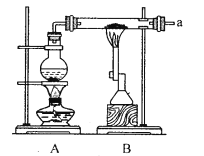
(1)铁粉与水蒸气反应的化学方程式为______;烧瓶中加入沸石的目的是_______
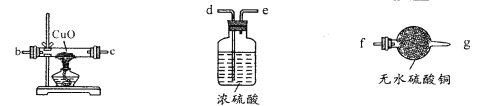
(2)用下图装置检验生成气体,连接顺序为(用字母表示)a![]() _______。
_______。
(3)证明反应后的固体中存在二价铁(限选试剂:1mol/LH2SO4、2mol/LHNO3、3%H2O2、0.01mol/LKMnO4、NaOH稀溶液、20%KSCN溶液、Fe2(SO4)3溶液)
步骤一:取反应后固体浸入Fe2(SO4)3溶液,充分反应后过滤并洗涤固体,其目的是_______;
步骤二:取过滤后所得固体加入过量_______,过滤;
步骤三:___________。
(4)取B中反应后的固体加足量稀硫酸溶解,再先后滴加KSCN溶液和氯水,溶液红色加深。请从平衡角度解释红色变深的原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂。实验室用无水氯化铁和氯苯来制备无水FeCl2。反应原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl
2FeCl2+C6H4Cl2+HCl
熔点(℃) | 沸点(℃) | 溶解性(水) | 溶解性 (乙醇) | 溶解性 (乙醚) | 其它 | |
FeCl3、FeCl2 | 易吸水 | 易溶 | 不溶 | 不溶于C6H5Cl 、C6H4Cl2 | ||
C6H5Cl | 45 | 132 | 不溶 | 易溶 | 易溶 | |
C6H4Cl2 | 53 | 173 | 不溶 | 易溶 | 易溶 |
现设计如下方案:在A中放入16.25 g无水氯化铁和过量的氯苯,控制反应温度在128-139℃加热3 h.冷却、分离提纯得到粗产品;烧杯中所得盐酸(假设HCl完全被吸收)用AgNO3溶液滴定以测氯化铁转化率。
请回答下列问题:

(1)仪器B的名称__________
(2)仪器C中盛装的试剂可以是_______
A.无水氯化钙 B.碱石灰 C.五氧化二磷 D.浓统酸
(3)反应后通入N2的目的是___________
(4)已知20![]() :时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
:时Ksp(AgCl,白色)=1.8×10-10,Ksp(Ag2CrO4,砖红色)=3.4×10-11.
将烧杯内溶液稀释至100 mL,每次取25.00 mL溶液进行滴定。选用K2CrO4做指示剂,用0.1000mol/L的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.20 mL,则滴定终点的现象是______,氯化佚的转化率是______________
(5)冷却实验装置,将三颈烧瓶内物质经过过滤、洗涤、干燥后,得到粗产品,洗涤所用最佳试剂是____;回收滤液中C6H5Cl的操作方法是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化碘是一种红棕色液体,不溶于水,溶于乙醇和乙酸,能与KI反应生成I2,用于测定油脂中的碘值等(注:碘值表示有机物中不饱和程度的指标)。某校研究性学习小组的同学拟制备一氯化碘(沸点101 ℃)。回答下列问题:
(1)甲组同学拟利用干燥纯净的氯气与碘反应制备一氯化碘,已知碘与氯气的反应为放热反应,其装置如下:
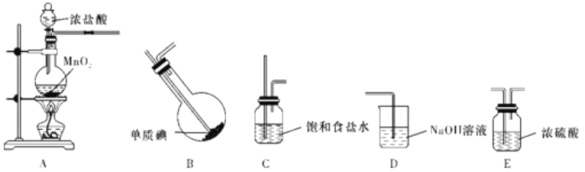
①各装置连接顺序为A→_______________________;
A中发生反应的离子方程式为________________________。
②B装置烧瓶需放在冷水中,其目的是________________________;
D装置的作用是________________________。
③B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_____。
(2)乙组同学采用最新报道制一氯化碘的方法,在三颈烧瓶中加入粗碘和盐酸,控制温度约50 ℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,则发生反应的化学方程式为_________________________。
(3)设计实验证明:ICl的氧化性比I2强:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的位置为_____________。
(2)X、Y、Z、M的原子半径由大到小排列为____(化学用语回答),Z在自然界中常见的二元化合物是__________。
(3)X与M的单质在高温下反应的化学方程式为_______,产物分子的电子式为_____,其化学键属__________共价键(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.8 g CO和H2混合气体,在足量的氧气中燃烧,产物全部通过足量的Na2O2,则Na2O2增重
A. 2 g B. 3.8 g C. 5 g D. 无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com