
����Ŀ����1����pH=l������ƽ���ֳ�2�ݣ�l�ݼ�����ˮ����1�ݼ�������������ʵ���Ũ����ͬ������NaOH��Һ��pH��������1��������ˮ��NaOH��Һ�������Ϊ_____��
��2����25���£���pH=3��������Һ��pH=10��NaOH��Һ��ϣ���Ҫʹ��Ϻ���Һ��pH=7����������Һ��NaOH��Һ�������ԼΪ___
��3����250Cʱ����pHΪa�������pHΪb��NaOH��Һ��ȡVa L�����ᣬͬ��NaOH��Һ�кͣ���Vb LNaOH��Һ����գ�
����a + b = 14����Va��Vb =_____�������֣���
����a + b = 13����Va��Vb =_______�������֣���
����a + b ��14����Va��Vb =______�������ʽ����
���𰸡�11:1 1:10 1 0.1 10a+b-14
��������
��1����ˮϡ�͡������������ƣ�������Ũ�ȶ���10-1��Ϊ10-2��
��2����pH=3��������Һ��pH=10��NaOH��Һ��ϣ���Ҫʹ��Ϻ���Һ��pH=7�����ǡ����ȫ��Ӧ��
��3����250Cʱ��Va L pHΪa������� Vb L pHΪb��NaOH��Һ��ȫ�кͣ�[H+]=[OH-] ����![]() ��
��
��1����ÿһ��������������1L��������Ũ�ȶ���10-1��Ϊ10-2�����ˮ�������V1����![]() ��V1=9L������������Ƶ������V2��
��V1=9L������������Ƶ������V2��![]() , V2=
, V2=![]() L��������ˮ��NaOH��Һ�������Ϊ11:1��
L��������ˮ��NaOH��Һ�������Ϊ11:1��
��2����Ϻ���Һ��pH=7�����ǡ����ȫ��Ӧ���轫xL pH=3��������Һ��yL pH=10��NaOH��Һ��ϣ���Ϻ���Һ��pH=7�� ![]() ��
��![]() ��
��
��3����![]() ��
��![]() ����a + b = 14����Va��Vb =1:1��
����a + b = 14����Va��Vb =1:1��
��![]() ��
��![]() ����a + b = 13����Va��Vb =1:10��
����a + b = 13����Va��Vb =1:10��
��![]() ��
��![]() ����a + b ��14����Va��Vb = 10a+b-14��
����a + b ��14����Va��Vb = 10a+b-14��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ��1L���ܱ������У�����2molA��1molB�������·�Ӧ��2A(g)+2B(g)![]() 3C(?)+D(?)����Ӧһ��ʱ���ﵽƽ�⣬�������0.6molC���ҷ�Ӧǰ��ѹǿ֮��Ϊ15��11(��ͬ�¶��²���)��������˵����ȷ���ǣ� ��
3C(?)+D(?)����Ӧһ��ʱ���ﵽƽ�⣬�������0.6molC���ҷ�Ӧǰ��ѹǿ֮��Ϊ15��11(��ͬ�¶��²���)��������˵����ȷ���ǣ� ��
A. �÷�Ӧ�Ļ�ѧƽ�ⳣ��KԼΪ0.043
B. ����C�����ʵ�����B��ƽ��ת���ʲ���
C. �������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D. A��ƽ��ת������40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.1 mol��L��1 NaCl��Һ��ָ����Һ�к���1 mol NaCl
B.��100 mLˮ����0.1 mol HCl����������Һ�����ʵ���Ũ��ǡ����1 mol��L��1
C.��62 g Na2O����ˮ�У����1 L��Һ���������ʵ����ʵ���Ũ��Ϊ2 mol��L��1
D.1 Lˮ���ܽ�5.85 g NaCl���γɵ���Һ�����ʵ���Ũ����0.1 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������14.4 g CO��CO2�Ļ�����壬�ڱ�״���£������Ϊ8.96 L���ش��������⣺
(1)�û�������ƽ��Ħ������Ϊ________________��
(2)���������̼ԭ�ӵĸ���Ϊ______________(��NA��ʾ�����ӵ�������ֵ)��
(3)�������������ͨ����ͼ��ʾװ�ã�ʣ����������ռ���������(ʵ���ڱ�״���²ⶨ)��
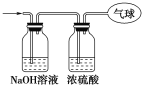
���������ռ����������У���������Ϊ________(��NA��ʾ�����ӵ�������ֵ)��
����������Ϊ________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ��治�����ױ��ʡ�ij����С��Ϊ�˴��Բⶨ�������Ƶ��������������dz�ȡ2.0g��Ʒ�����������ͼװ�����ⶨ�������Ƶ�����������ͼ�е�E��F��������װ�ã������ⶨO2�������
| |||||
A | B | C | D | E | F |
(1)д��װ��A��������Ҫ��������������__________��_______��
(2)д��װ��A�з��������ӷ���ʽ____________________________��
(3)װ��B��������______________________________��
(4)д��װ��C�з�����Ӧ����Ҫ��ѧ����ʽ��______________________________��
(5)װ��D�� NaOH��������________________________________________��
(6)�����ڶ�����Ͳ��ˮ�������������ɱ�״�������������Ϊ224mL������Ʒ�й������Ƶ���������Ϊ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ���̿�ʯ����Ҫ�ɷ�Ϊ![]() ��
��![]() ������Ũ���ᷢ�����·�Ӧ�����ʲ����뷴Ӧ��
������Ũ���ᷢ�����·�Ӧ�����ʲ����뷴Ӧ��![]() ���Ƶ�
���Ƶ�![]() ����״�����������й�˵���в���ȷ���ǣ� ��
����״�����������й�˵���в���ȷ���ǣ� ��
A. �������̿�ʯ��![]() ����������Ϊ
����������Ϊ![]()
B. ��������![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]()
C. �μӷ�Ӧ��![]() ������Ϊ
������Ϊ![]()
D. ����ԭ��![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ij��ɫ��ˮ�п��ܺ���H����NH4+��Fe3����Al3����Mg2����Na����NO3-��CO32-��SO42-�еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ1 L������������ʵ�飬��������й�ͼ��������ʾ��

��ش��������⣺
��1����������3��ʵ����Է�����ˮ��һ�������ڵ���������________��һ�����ڵ���������________��
��2��д��NH4+�ĵ���ʽ________��
��3������ͼ����ԭ��Һ��c��NH4+����c��Al3�����ı�ֵΪ____�����ó��������������___g��
��4����ͨ��ʵ��ȷ��ԭ��ˮ��c��Na���� ��0.18 mol��L��1�����ж�ԭ��ˮ��NO3-�Ƿ���ڣ�________����������������������������ȷ�������������ڣ�c��NO3-����________ mol��L��1�����������ڻ�ȷ����˿ղ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���������ȷ����
A.���Ʊ�����ˮ��Ũ��������¾����������������ɷ��ж�������
B.����NaOH����ʱ����ʹ�ô���������Ϊ�������е�SiO2����NaOH��Ӧ
C.���ڿ�����������ȼ�գ�����Գʻ�ɫ�������ɹ�����ɫ��ͬ
D.Ũ������н�ǿ���ԣ�����Cu��Ӧ����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(NiSO4)��һ����Ҫ�Ļ���ԭ�ϣ��㷺Ӧ���ڵ�ơ�ҽҩ��ӡȾ�ȹ�ҵ���Ժ����ϴ���(��Ҫ��Ni��������Al��Al2O3��Fe�������������ᡢ�������)Ϊԭ������NiSO4��7H2O��������ֹ����������£�
����һ��
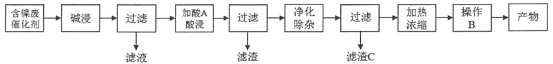
���̶���

��֪�����ֽ������������Ksp����ֵ���±���ʾ��
��ѧʽ | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp����ֵ | 10��17 | 10��39 | 10��34 | 10��15 |
�ش��������⣺
(1)����һ��������A�����̶���������X___________(������ͬ����������ͬ��)������һ������C�����̶�������II___________(������ͬ����������ͬ��)�����̶�������I��___________��
(2)����һ���������ʱ������Ӧ�����ӷ���ʽΪ_________________��___________________��
(3)���̶��������������������������������̣���һ��������������H2O2��������Ӧ�����ӷ���ʽ��____________________________________________���ڶ�����������Һ��pH��
(4)�����Ƚ�����һ�в���B�����̶��в���Y�ش����Y��___________��___________�����ˡ�ϴ�ӡ�������ò��
(5)�ɼ�֪��Ϣ��ʽ���㣺�����£�Ni2����ȫ����ʱ��pHֵ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com