
【题目】硫酸镍(NiSO4)是一种重要的化工原料,广泛应用于电镀、医药、印染等工业。以含镍废催化剂(主要含Ni及少量的Al、Al2O3、Fe和其它不溶于酸、碱的杂质)为原料生产NiSO4·7H2O晶体的两种工艺流程如下:
流程一:
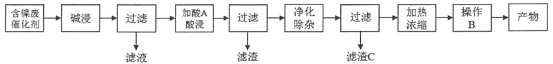
流程二:

已知:部分金属氢氧化物的Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
回答下列问题:
(1)流程一中所用酸A和流程二中所用酸X___________(填“相同”或“不相同”);流程一中滤渣C和流程二中滤渣II___________(填“相同”或“不相同”)。流程二中滤渣I是___________。
(2)流程一中“碱浸”时发生反应的离子方程式为_________________、___________________。
(3)流程二中“净化除杂”包含了两步操作过程:第一步,加入氧化剂H2O2,发生反应的离子方程式是____________________________________________;第二步,调节溶液的pH。
(4)分析比较流程一中操作B和流程二中操作Y后,回答操作Y是___________、___________、过滤、洗涤、干燥,即得产物。
(5)由己知信息列式计算:常温下,Ni2+完全沉淀时的pH值___________。
【答案】相同 不相同 其它不溶于酸、碱的杂质 2Al + 2OH- +2H2O=2AlO2- + 3H2↑ Al2O3 + 2OH- =2AlO2- + H2O 2Fe2++ H2O2+2H+= 2Fe3++2H2O 蒸发浓缩 冷却结晶 9
【解析】
流程一:由流程可知,某化工厂的含镍催化剂主要含有Ni,还含有Al、Al2O3、Fe和其它不溶于酸、碱的杂质,用NaOH碱浸时溶解Al和Al2O3,过滤得到固体是Ni、Fe和不溶于酸、碱的杂质,加入稀硫酸酸浸过滤,所得滤液主要含有Fe2+和Ni2+,加入过氧化氢氧化亚铁离子为铁离子,调节溶液pH使铁离子全部生成Fe(OH)3沉淀,镍离子不沉淀,过滤后调节溶液pH:2-3,以防止镍离子水解,通过蒸发浓缩,冷却结晶,过滤洗涤得到NiSO47H2O晶体;
流程二:某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质,工艺流程的目的是用含镍废催化剂制备NiSO47H2O晶体,分析工艺流程,将含Ni废催化剂用稀硫酸酸浸,则Ni、Al、Fe和Al2O3均溶于酸,得到Al3+、Fe2+和Ni2+,进行过滤操作,则不溶于酸的杂质被过滤出,滤液中主要含有Al3+、Fe2+和Ni2+,净化除杂主要除去Al3+、Fe2+,得到Ni2+的溶液,经过后续处理得到NiSO47H2O晶体,以此解答该题。
(1)由流程分析知:目标产物均为NiSO47H2O,则流程一中所用酸A和流程二中所用酸X均为稀硫酸;流程一中滤渣C为Fe(OH)3沉淀,而流程二中滤渣II为Al(OH)3和Fe(OH)3沉淀,则流程一中滤渣C和流程二中滤渣II不相同;流程二中滤渣I是其它不溶于酸、碱的杂质;
(2)流程一中“碱浸”时用NaOH溶液溶解Al和Al2O3,均生成NaAlO2,前者还有H2生成,发生反应的离子方程式为2Al + 2OH- +2H2O=2AlO2-+ 3H2↑、Al2O3 + 2OH-=2AlO2-+ H2O;
(3)流程二中“净化除杂”包含了两步操作过程:第一步,加入氧化剂H2O2,目的是氧化溶液中的Fe2+生成Fe3+,发生反应的离子方程式是2Fe2++ H2O2+2H+= 2Fe3++2H2O;
(4)流程二中从溶液中获得NiSO47H2O的操作Y是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即得产物。
(5)由Ksp(Ni(OH)2)=c(Ni2+)×c2(OH-)=10-15,Ni2+完全沉淀时c(Ni2+)<1×10-5mol/L,则Ni2+完全沉淀时的c(OH-)=![]() mol/L=1×10-5mol/L,此时溶液的pH=-lg
mol/L=1×10-5mol/L,此时溶液的pH=-lg![]() =9。
=9。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】(1)将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为_____。
(2)在25℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为___
(3)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取Va L该盐酸,同该NaOH溶液中和,需Vb LNaOH溶液。填空:
①若a + b = 14,则Va∶Vb =_____(填数字)。
②若a + b = 13,则Va∶Vb =_______(填数字)。
③若a + b >14,则Va∶Vb =______(填表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论是干重还是鲜重,组成水生动物、人体细胞的元素中含量最多的四种元素是
A.O、N、H、CaB.O、Ca、P、Mg
C.C、O、N、HD.C、Fe、Ca、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钠、铁都能与水反应,下列叙述不正确的是( )
A.它们反应的难易程度不同B.它们反应的产物不完全相同
C.都需在高温条件下进行D.反应类型都是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/L的H3A溶液的滴定曲线如图所示。己知H3A的pKa1-pKa3分别为2、7和12(pKa=-lgKa)下列说法正确的是

A.滴定前溶液pH值约为3
B.第一个计量点可以用酚酞作为指示剂
C.到达第二个计量点时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达第三个计量点时,微热溶液,![]() 会增大
会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是一种重要的化工原料。工业上采用以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3。Al2O3)为原料生产硼酸和轻质氧化镁,其工艺流程如下:
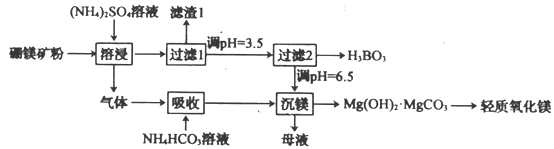
下列叙述错误的是
A.“溶浸”中产生的气体是氨气
B.“滤渣1”是SiO2
C.“过滤2”前,将溶液pH调节至3.5,目的是转化为硼酸沉淀
D.“沉镁”中得到的母液经加热后可返回“溶浸”工序循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p轨道的电子数等于次外层的电子总数,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。根据以上条件,回答下列问题:
(1)画出C的原子结构示意图:________。
(2)写出D原子的外围电子排布式:________。
(3)写出A元素单质在B中完全燃烧的化学方程式:______________。
(4)指出E元素在元素周期表中的位置:____________。
(5)比较A、B、C三种元素的第一电离能的大小顺序:________________(按由大到小的顺序排列,用元素符号表示)。
(6)比较元素D和E的电负性的相对大小:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硫酸铝溶液中滴加过量浓氨水:Al3+ + 4OH- = AlO![]() + 2H2O
+ 2H2O
B. NaHCO3溶液水解:HCO![]() + H2O = H2CO3 + OH-
+ H2O = H2CO3 + OH-
C. 浓氢氧化钠溶液吸收少量SO2气体:SO2+ 2OH- = SO![]() + H2O
+ H2O
D. 向小苏打溶液中加入醋酸溶液:HCO![]() + H+= CO2↑+ H2O
+ H+= CO2↑+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com