
【题目】用0.1000 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/L的H3A溶液的滴定曲线如图所示。己知H3A的pKa1-pKa3分别为2、7和12(pKa=-lgKa)下列说法正确的是

A.滴定前溶液pH值约为3
B.第一个计量点可以用酚酞作为指示剂
C.到达第二个计量点时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达第三个计量点时,微热溶液,![]() 会增大
会增大
【答案】C
【解析】
A.己知pKa1=2,即lgKa1=-2,则Ka1=10-2,由H3A![]() H2A-+H+可知未滴定前Ka1=
H2A-+H+可知未滴定前Ka1=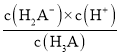 ,则c(H+)≈
,则c(H+)≈![]() mol/L=10-1.5mol/L,此时溶液pH=1.5,故A错误;
mol/L=10-1.5mol/L,此时溶液pH=1.5,故A错误;
B.第一个计量点恰好完全反应生成NaH2A,此时溶液中H2A-的水解常数Kh=![]() =
=![]() =10-10,即H2A-的电离程度大于H2A-的水解程度,溶液显酸性,则不能使用酚酞作指示剂,可选择甲基橙作指示剂,故B错误;
=10-10,即H2A-的电离程度大于H2A-的水解程度,溶液显酸性,则不能使用酚酞作指示剂,可选择甲基橙作指示剂,故B错误;
C.到达第二个计量点时恰好生成Na2HA,此时溶液中HA2-的水解常数Kh2=![]() =
=![]() =10-7,即HA2-的电离程度等于HA2-的水解程度,溶液显中性,由溶液中的电荷守恒式c(Na+)+ c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-)可得c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-),故C正确;
=10-7,即HA2-的电离程度等于HA2-的水解程度,溶液显中性,由溶液中的电荷守恒式c(Na+)+ c(H+)=c(OH-)+c(H2A-)+2c(HA2-)+3c(A3-)可得c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-),故C正确;
D.到达第三个计量点时,恰好生成Na3A,此时溶液中存在A3-的三级水解,且加热促进水解,即加热过程中c(A3-)减小,c(H2A-)增大,则![]() 会减小,故D错误;
会减小,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取2.0g样品,并设计用下图装置来测定过氧化钠的质量分数。图中的E和F构成量气装置,用来测定O2的体积。
| |||||
A | B | C | D | E | F |
(1)写出装置A中两种主要玻璃仪器的名称__________、_______。
(2)写出装置A中发生的离子方程式____________________________。
(3)装置B的作用是______________________________。
(4)写出装置C中发生反应的主要化学方程式:______________________________。
(5)装置D中 NaOH的作用是________________________________________。
(6)他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A.用铁电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.Fe(NO3)3溶液中加入过量的HI溶液2Fe3++2I-=2Fe2++I2
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年南京理工大学合成出下图的离子化合物,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是
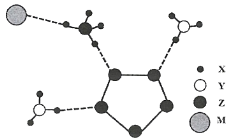
A.X与Y形成的化合物沸点高于Y同族元素与X形成的化合物
B.Z的最高价氧化物对应水化物的酸性比M的强
C.Y气态氢化物的稳定性比Z的强
D.在该盐中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍(NiSO4)是一种重要的化工原料,广泛应用于电镀、医药、印染等工业。以含镍废催化剂(主要含Ni及少量的Al、Al2O3、Fe和其它不溶于酸、碱的杂质)为原料生产NiSO4·7H2O晶体的两种工艺流程如下:
流程一:
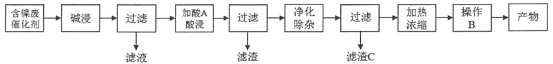
流程二:

已知:部分金属氢氧化物的Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
回答下列问题:
(1)流程一中所用酸A和流程二中所用酸X___________(填“相同”或“不相同”);流程一中滤渣C和流程二中滤渣II___________(填“相同”或“不相同”)。流程二中滤渣I是___________。
(2)流程一中“碱浸”时发生反应的离子方程式为_________________、___________________。
(3)流程二中“净化除杂”包含了两步操作过程:第一步,加入氧化剂H2O2,发生反应的离子方程式是____________________________________________;第二步,调节溶液的pH。
(4)分析比较流程一中操作B和流程二中操作Y后,回答操作Y是___________、___________、过滤、洗涤、干燥,即得产物。
(5)由己知信息列式计算:常温下,Ni2+完全沉淀时的pH值___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s) + 2B(g)![]() C(g) + D(g) 已达到平衡状态‘
C(g) + D(g) 已达到平衡状态‘
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度(T℃)时,水的Kw=1×10-12,则该温度___(填“>”、“<”或“=”)25℃,其理由是___。
(2)该温度下,c(H+)=1×10-7mol·L-1的溶液呈___(填“酸性”、“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mL 含Mg2+、Al3+、NH4+、H+、Cl- 、的溶液中,逐滴加入5 mol·L-1的NaOH溶液并微热,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示

(1)x-y=____________。
(2)加入33~35 mLNaOH溶液时的离子方程式:_________________________________。
(3)产生的氨气在标准状况下的体积_________________________mL。
(4)原溶液中n(Mg2+):n(Al3+)=______________________。
(5)原溶液中c(Cl-)=______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com