
����Ŀ���������ӷ���ʽ����ȷ����
A.�����缫��ⱥ��ʳ��ˮ��2Cl����2H2O![]() 2OH����H2����Cl2��
2OH����H2����Cl2��
B.Fe(NO3)3��Һ�м��������HI��Һ2Fe3����2I����2Fe2����I2
C.����SO2ͨ��Ca(ClO)2��Һ�У�SO2��H2O��Ca2����2ClO����CaSO3����2HClO
D.��Mg(HCO3)2��Һ�м��������NaOH��Һ��Mg2����2HCO3����4OH����Mg(OH)2����2CO32����2H2O
���𰸡�D
��������
A�������缫��ⱥ��ʳ��ˮʱ������FeҪ�ܽ⣬���������ӷ�ӦΪFe��2H2O![]() Fe(OH)2��+H2������A����
Fe(OH)2��+H2������A����
B��NO3-������������Ҳ��ǿ�����ԣ�������I-����Fe(NO3)3��Һ�м��������HI��Һ�����������ӷ���ʽΪ12H��+3NO3��+Fe3��+10I��=3NO��+Fe2��+5I2+6H2O����B����
C��SO2�н�ǿ��ԭ�ԣ�HClO��ǿ�����ԣ�������SO2ͨ��Ca(ClO)2��Һ�з��������ӷ�ӦΪCa2++3ClO-+SO2+H2O=CaSO4��+2HClO+Cl-����C����
D����Mg(HCO3)2��Һ�м��������NaOH��Һ���������ӷ�Ӧ����ʽΪMg2����2HCO3����4OH����Mg(OH)2����2CO32����2H2O����D��ȷ��
�ʴ�ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷����壨FeSO4��7H2O��M=278g/mol��������ȱ����ƶѪҩƷ����Ҫ�ɷ֡�ʵ�����������᳧����������Ҫ�ɷ�ΪFe2O3������FeS��SiO2�����Ʊ��̷��Ĺ������£�
 �Իش𣺣�1��������Ϊ_____________����д�������ƣ���
�Իش𣺣�1��������Ϊ_____________����д�������ƣ���
��2�� �Լ�Y����ҺX��Ӧ�����ӷ���ʽΪ__________________________________��
��3�����������̷������к���Fe2+��ʵ�������________________________________��
��4���������˳������Ϊ��_______________����ȴ�ᾧ������ ��__________�����
��5��ijͬѧ������KMnO4��Һ�ⶨ�̷���Ʒ��Fe2+������
a.��ȡ11.5g�̷���Ʒ���ܽ⣬���Ƴ�1000mL��Һ��
b.��ȡ25.00mL������Һ����ƿ�У�
c.�������ữ��0.01000mol/L KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL��
�ٲ���a������Һʱ��Ҫ�IJ�������������������Ͳ���ձ�����ͷ�ι��⣬����___________��
�ڸ�ͬѧ��Ƶ����еζ���ʽ�����������____________(�гֲ�����ȥ)(����ĸ���)��
�۵ζ�ʱ������Ӧ�����ӷ���ʽΪ��_______________________________________��
���жϴ˵ζ�ʵ��ﵽ�յ�ķ�����_____________________________�����ڵζ��յ��ȡ�ζ��̶ܿ�ʱ������KMnO4��ҺҺ�棬������������ȷ����ʹ�ⶨ���________������ƫ������ƫ��������Ӱ��������
�ݼ���������Ʒ��FeSO4��7H2O����������Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����̼��ԭ4.64 gij��������������ɵĶ�����̼ȫ��ͨ�뵽�����ij���ʯ��ˮ�У��õ��ij������������Ϊ8.0 g����˽����������������е�(����)
A. ����ͭ B. ������ C. ���������� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ��ػ������أ����ˮ���������ϸ����Ԫ���к�����������Ԫ����
A.O��N��H��CaB.O��Ca��P��Mg
C.C��O��N��HD.C��Fe��Ca��P
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���У��ܴﵽʵ��Ŀ�ĵ���
A. ʵ������ȡ����
ʵ������ȡ����
B.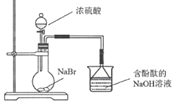 �ձ��к�ɫ��ȥ��֤������HBr
�ձ��к�ɫ��ȥ��֤������HBr
C. ʵ������ȡ����
ʵ������ȡ����
D.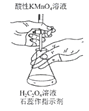 ������KMnO4��Һ�ζ�HCO4��Һ
������KMnO4��Һ�ζ�HCO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ơ���������ˮ��Ӧ��������������ȷ����(����)
A.���Ƿ�Ӧ�����׳̶Ȳ�ͬB.���Ƿ�Ӧ�IJ��ﲻ��ȫ��ͬ
C.�����ڸ��������½���D.��Ӧ���Ͷ����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1000 mol/L NaOH��Һ�ζ�20.00 mL 0.1000 mol/L��H3A��Һ�ĵζ�������ͼ��ʾ����֪H3A��pKa1��pKa3�ֱ�Ϊ2��7��12(pKa����lgKa)����˵����ȷ����

A.�ζ�ǰ��ҺpHֵԼΪ3
B.��һ������������÷�̪��Ϊָʾ��
C.����ڶ���������ʱ����Һ�д���c(Na��)��c(H2A��)��2c(HA2��)��3c(A3��)
D.���������������ʱ������Һ��![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ�������£��������·�Ӧ��NO(g)��CO(g) ![]()
![]() N2(g)+CO2(g)����H= -373.2kJ/mol���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��
N2(g)+CO2(g)����H= -373.2kJ/mol���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��
A.�Ӵ���ͬʱ�����¶�B.�Ӵ���ͬʱ����ѹǿ
C.�����¶�ͬʱ����N2D.�����¶�ͬʱ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. ��������ʮ�����ʣ�
��Һ̬HCl ��NaHCO3 ������NaCl ��CO2 �����Ǿ��� ��Ba(OH)2��Һ �������������� �ఱˮ ����� ��NaHSO4
(1)����ʮ�����������ڵ���ʵ���_______________������ţ���
(2)����ˮ��Һ�еĵ��뷽��ʽΪ__________________________________��
II.�ຣ������Ϊʮ��ǰ�������˻ά��������������Ҫ�ɷ����ɡ���ʯ���͡�����ʯ����ɵ���ά״������壬��ʯ��Tremolite���Ļ�ѧ�ɷ�ΪCa2Mg5Si8O22(OH)2����ʯ�Ļ�ѧʽд�����������ʽΪ__________________________��
III.ʵ������Ҫ����������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ��������1.0 mol��L��1��ϡ������Һ450mL����ش���������
(1)��Ҫ����Ͳ��ȡ��Ũ��������Ϊ____________ mL��
(2)��������������ϡ������ҺŨ�ȣ��ƫ�ߡ�����ƫ�͡�����Ӱ�족��
������Ͳ��ȡŨ�����ϴ����Ͳ����ϴ��Һת�Ƶ�����ƿ_______________��
��������ƿ��ˮ����ʱ�۾�����Һ��_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com