
【题目】在200mL 含Mg2+、Al3+、NH4+、H+、Cl- 、的溶液中,逐滴加入5 mol·L-1的NaOH溶液并微热,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示

(1)x-y=____________。
(2)加入33~35 mLNaOH溶液时的离子方程式:_________________________________。
(3)产生的氨气在标准状况下的体积_________________________mL。
(4)原溶液中n(Mg2+):n(Al3+)=______________________。
(5)原溶液中c(Cl-)=______________________。
【答案】0.01mol Al(OH)3+OH-=AlO2-+2H2O 336 5:1 0.825 mol/L
【解析】
由给出的离子在滴入NaOH溶液时发生H++OH﹣═H2O,Mg2+、Al3+结合OH﹣生成沉淀,NH4+与OH﹣反应,氢氧化铝与OH﹣反应而溶解,并结合图象可知,0~4mL时发生酸碱中和,4mL~30mL发生Mg2+、Al3+结合OH﹣生成沉淀的反应,30mL~33mL发生NH4+与OH﹣反应,33mL~35mL发生氢氧化铝的溶解反应,然后利用离子反应方程式来计算解答。
(1)由图及离子反应可知x﹣y的值即为Al(OH)3的物质的量,
则设Al(OH)3的物质的量为n,
Al(OH)3+OH﹣═AlO2﹣+2H2O
1 1
n (35﹣33)×0.001L×5molL﹣1,解得n=0.01mol,即x﹣y=0.01mol,故答案为:0.01mol;
(2)加入33~35 mLNaOH溶液时,沉淀质量减少,故反应的离子方程式为 Al(OH)3+OH﹣═AlO2﹣+2H2O,故答案为:Al(OH)3+OH﹣═AlO2﹣+2H2O;
(3)加入30~33 mLNaOH溶液时,沉淀质量不变,故反应的离子方程式为NH4++OH﹣![]() NH3↑+H2O,
NH3↑+H2O,
NH4++OH﹣![]() NH3↑+H2O
NH3↑+H2O
1 1
(33﹣30)×0.001L×5molL﹣1 n
解得n=0.015mol,则体积为0.015mol×22.4L/mol=0.336L=336mL,故答案为:336;
(4)由4mL~30mL发生Mg2+、Al3+结合OH﹣生成沉淀的反应,
则 Al3++3OH﹣═Al(OH)3↓
1 3 1
0.01mol 0.03mol 0.01mol
设镁离子的物质的量为m,
Mg2++2OH﹣═Mg(OH)2↓
1 2
m (30﹣4)mL×0.001L×5molL﹣1﹣0.03mol,解得m=0.05mol,
则原溶液中n(Mg2+):n(Al3+)=0.05:0.01=5:1,故答案为:5:1;
(5)由图可知,加入33mLNaOH溶液时Cl﹣离子以NaCl存在,设Cl﹣离子的物质的量为z,由钠和氯原子守恒可知
NaOH~NaCl~Cl﹣,
1 1
33×0.001L×5molL﹣1 z,解得z=0.165mol,
则原溶液中Cl﹣的物质的量浓度为![]() =0.825mol/L,故答案为:0.825mol/L。
=0.825mol/L,故答案为:0.825mol/L。


科目:高中化学 来源: 题型:
【题目】用0.1000 mol/L NaOH溶液滴定20.00 mL 0.1000 mol/L的H3A溶液的滴定曲线如图所示。己知H3A的pKa1-pKa3分别为2、7和12(pKa=-lgKa)下列说法正确的是

A.滴定前溶液pH值约为3
B.第一个计量点可以用酚酞作为指示剂
C.到达第二个计量点时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达第三个计量点时,微热溶液,![]() 会增大
会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
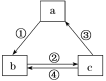
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Si | SiO2 | H2SiO3 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | Fe | FeCl3 | FeCl2 | ④加入氯气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 现有下列十种物质:
①液态HCl ②NaHCO3 ③熔融NaCl ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2溶液 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩NaHSO4
(1)上述十种物质中属于电解质的有_______________(填序号)。
(2)⑩在水溶液中的电离方程式为__________________________________。
II.青海昆仑玉被定为十年前北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2。透闪石的化学式写成氧化物的形式为__________________________。
III.实验室需要用质量分数为98%、密度为1.84g/cm3的浓硫酸配制1.0 mol·L-1的稀硫酸溶液450mL,请回答下列问题
(1)需要用量筒量取的浓硫酸的体积为____________ mL。
(2)下面操作造成所配稀硫酸溶液浓度(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶_______________。
②向容量瓶加水定容时眼睛俯视液面_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y的原子最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题:
(1)Y、Z、M、G四种元素的原子半径由大到小的顺序是____________ (用元素符号表示)。
(2)Z在元素周期表中的位置为____________,M2Z的电子式为____________。
(3)上述元素的最高价氧化物对应的水化物中,酸性最强的水化物是__________(写化学式)。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且它的产量可以用来衡量一个国家的石油化工发展水平的是____________ (写名称)。
(5)GQ3溶液与过量的MZX溶液反应的化学方程式为_________________________________
(6)常温下,不能与G的单质发生反应的是____________ (填标号)。
a.CuSO4溶液 b.浓硫酸 c.NaOH溶液 d.浓硝酸 e.氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 硫酸铝溶液中滴加过量浓氨水:Al3+ + 4OH- = AlO![]() + 2H2O
+ 2H2O
B. NaHCO3溶液水解:HCO![]() + H2O = H2CO3 + OH-
+ H2O = H2CO3 + OH-
C. 浓氢氧化钠溶液吸收少量SO2气体:SO2+ 2OH- = SO![]() + H2O
+ H2O
D. 向小苏打溶液中加入醋酸溶液:HCO![]() + H+= CO2↑+ H2O
+ H+= CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢氧化钠和氢氧化钡混合溶液的pH=14,现取100mL该混合溶液,加入100mL0.4mol/LH2SO4溶液时生成的沉淀已达最多(溶液的体积变化忽略不计),计算回答下列问题:(无计算过程不得分)
(1)原混合溶液中氢氧化钠和氢氧化钡的物质的量浓度为多少?____
(2)反应后所得溶液的pH为多少?____
查看答案和解析>>
科目:高中化学 来源: 题型:
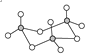
【题目】(1)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,从电子云重叠方式看共价键的类型有________种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(2)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__。
图1 FexNy晶胞结构示意图 图2转化过程的能量变化
图2转化过程的能量变化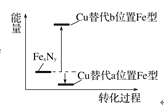
(3)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为__ nm,与K紧邻的O个数为____。
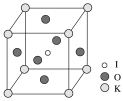
(4)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于_______位置,O处于______位置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com