
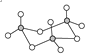
【题目】(1)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,从电子云重叠方式看共价键的类型有________种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(2)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__。
图1 FexNy晶胞结构示意图 图2转化过程的能量变化
图2转化过程的能量变化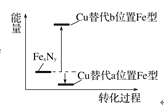
(3)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为__ nm,与K紧邻的O个数为____。
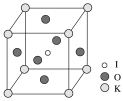
(4)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于_______位置,O处于______位置。
【答案】平面三角 2 sp3 Fe3CuN 0.315 (或 ![]() ×0.446) 12 体心 棱心
×0.446) 12 体心 棱心
【解析】
(1) SO3中S原子价层电子对数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S-O原子之间存在共价键;该分子中每个S原子价层电子对数都是4,根据价层电子对互斥理论判断S原子杂化类型;
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S-O原子之间存在共价键;该分子中每个S原子价层电子对数都是4,根据价层电子对互斥理论判断S原子杂化类型;
(2) 能量越低越稳定,故Cu替代a位置的Fe形成的物质更稳定,形成晶胞中N原子处于体心、Cu原子处于顶点、Fe原子处于面心,利用均摊法计算晶胞中各原子数目,进而确定化学式;
(3) K与O间的最短距离为面对角线的一半;O位于面心,K位于顶点,1个面心为2个晶胞共有,1个顶点为8个晶胞共有;
(4) 在KIO3晶胞结构的另一种表示中,I处于各顶角位置,个数为8×![]() =1,则K也为1,应位于体心,则O位于棱心,个数为12×
=1,则K也为1,应位于体心,则O位于棱心,个数为12×![]() =3。
=3。
(1) SO3中S原子价层电子对数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S-O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3;
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S-O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3;
(2) 能量越低越稳定,故Cu替代a位置的Fe形成的物质更稳定,形成晶胞中N原子处于体心、Cu原子处于顶点、Fe原子处于面心,晶胞中N原子数目=1,N(Cu)=8×![]() =1,N(Fe)=6×
=1,N(Fe)=6×![]() =3,故化学式为:Fe3CuN;
=3,故化学式为:Fe3CuN;
(3) K与O间的最短距离为面对角线的一半,则K与O间的最短距离为![]() ×0.446nm=0.315nm,O位于面心,K位于顶点,1个面心为2个晶胞共有,1个顶点为8个晶胞共有,即与K紧邻的O个数为
×0.446nm=0.315nm,O位于面心,K位于顶点,1个面心为2个晶胞共有,1个顶点为8个晶胞共有,即与K紧邻的O个数为![]() =12个;
=12个;
(4) 在KIO3晶胞结构的另一种表示中,I处于各顶角位置,个数为8×![]() =1,则K也为1个,应位于体心,则O位于棱心,每个棱为4个晶胞共有,则O个数为12×
=1,则K也为1个,应位于体心,则O位于棱心,每个棱为4个晶胞共有,则O个数为12×![]() =3。
=3。


科目:高中化学 来源: 题型:
【题目】在200mL 含Mg2+、Al3+、NH4+、H+、Cl- 、的溶液中,逐滴加入5 mol·L-1的NaOH溶液并微热,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示

(1)x-y=____________。
(2)加入33~35 mLNaOH溶液时的离子方程式:_________________________________。
(3)产生的氨气在标准状况下的体积_________________________mL。
(4)原溶液中n(Mg2+):n(Al3+)=______________________。
(5)原溶液中c(Cl-)=______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol·L-1,含硝酸的浓度为1 mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.224 mLB.168 mL
C.112 mLD.89.6 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
实际应量取盐酸体积/ml | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
______________ | ______________ | ______________ |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)______________;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________________________________,溶液注入容量瓶前需恢复到室温,这是因为______________________________________;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作_______________;若加蒸馏水时不慎超过了刻度_______________;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度_______________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关含氯物质的说法不正确的是
A.向新制氯水中加入少量碳酸钙粉末能增强溶液的漂白能力
B.向NaClO溶液中通入少量的CO2的离子方程式:CO2+2ClO-+H2O=2HClO+CO32-(已知酸性:H2CO3>HClO>HCO3-)
C.向Na2CO3溶液中通入足量的Cl2的离子方程式:2Cl2+CO32-+H2O=CO2+2Cl-+2HClO
D.室温下,向NaOH溶液中通入Cl2至溶液呈中性时,相关粒子浓度满足:c(Na+)=2c(ClO-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国的高铁技术居于国际领先地位。
①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于____(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是____(填字母)。
a.铜 b.石墨 c.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和____(填字母)。
a.石灰石 b.粗盐 c.纯碱
(2)营养均衡有利于身体健康。
①人体内提供能量的主要营养物质为____、糖类和蛋白质。淀粉在人体内水解的最终产物是____。
②维生素是人体需要的营养物质。如图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是____,甜味剂是___。泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和___反应释放出了气体。

(3)煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。
①控制燃煤产生的SO2排放,能够减少____型酸雨的形成。燃煤排放的烟气中还含有其他污染物,请列举一种:_____。
②燃煤产生的CO2用NH3处理可生产多种化工产品。用氨水吸收CO2可制得碳铵(NH4HCO3),写出该反应的化学方程式_____。用液氨与CO2反应可制备尿素[CO(NH2)2]。尿素和碳铵这两种氮肥中,氮元素的质量分数较高的是_____。
③煤的气化和液化是实现能源清洁化的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是
A. CH2BrB. CH2BrCH2CH2CH2Br
C. CH2BrCH2CH2BrD. CH3CH2CH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙的实验如下:
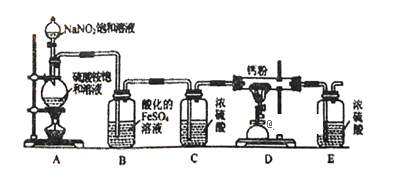
Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_______________________________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为______________________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①点燃D处的酒精喷灯; ②打开分液漏斗活塞; ③点燃A处的酒精灯; ④停上点燃A处的酒精灯;⑤停止点燃D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com