
【题目】三氯化磷(PCl3)是一种基础化工原料使用广泛需求量大。实验室可用白磷与氯气反应制备三氯化磷,实验装置如图所示(夹持装置未画出)。
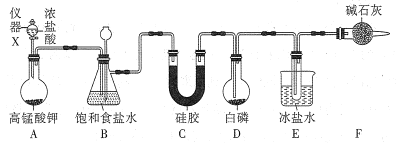
已知:①氯气与白磷反应放出热量(温度高于75℃)。
②PCl3和PCl5遇水强烈反应并产生大量的白雾。
③PCl3和PCl5的物理常数如下:
熔点 | 沸点 | |
PCl3 | -112℃ | 76℃ |
PCl5 | 146℃ | 200℃分解 |
回答下列问题:
(1)仪器X的名称是___;装置A中发生反应的离子方程式为___。
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C或D中是否发生堵塞,若装置C或D中发生堵塞时B中的现象是__。
(3)为防止装置D因局部过热而炸裂,实验开始前应在圆底烧瓶的底部放少量__(填“干沙”或“水”)。
(4)装置E的烧杯中冰盐水的作用是___。
(5)装置F的作用:一是防止空气中水蒸气的进入;二是___。
(6)前期白磷过量生成PCl3,后期氯气过量生成PCl5,从PC13和PCl5的混合物中分离出PCl3的最佳方法是___。
【答案】分液漏斗 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 吸滤瓶中液面下降,长颈漏斗中液面上升 干沙 使三氯化磷蒸汽充分冷凝 吸收过量的氯气 蒸馏
【解析】
实验室可用白磷与氯气反应制备三氯化磷:装置A由高锰酸钾与浓盐酸制备氯气,离子反应为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,制得的氯气混有HCl气体,B装置中的饱和食盐水吸收HCl气体,同时也是安全瓶,能监测实验进行时装置C或D中是否发生堵塞,若发生堵塞,吸滤瓶中液面下降,长颈漏斗中液面上升,C装置干燥氯气,纯净干燥的氯气在D中与白磷反应生成三氯化磷,E装置冷凝三氯化磷蒸汽,装置F防止空气中水蒸气的进入,同时吸收过量的氯气,防止污染空气。
(1)根据图示仪器X为分液漏斗;装置A中由高锰酸钾与浓盐酸制备氯气,反应为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;故答案为:分液漏斗;2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(2)装置C或D中是否发生堵塞,则装置B中气体压强增大,会把吸滤瓶中的液体压入长颈漏斗中,导致吸滤瓶中液面下降,长颈漏斗中液面上升;故答案为:吸滤瓶中液面下降,长颈漏斗中液面上升;
(3)为防止装置D因局部过热而炸裂,通常会在底部铺上一层沙子或加入一定量的水,因为三氯化磷会水解,所以只能用干沙;故答案为:干沙;
(4)三氯化磷熔沸点低,通过降温可将其转化为液体,在E中收集;故答案为:使三氯化磷蒸汽充分冷凝;
(5)氯气是有毒气体,未反应完的氯气会造成大气污染,空气中的水蒸气进入D装置也会影响三氯化磷的制备。所以装置F的作用:一是防止空气中水蒸气的进入E,引起三氯化磷的水解,二是吸收过量的氯气,防止污染空气;故答案为:吸收过量的氯气;
(6)氯气逐渐过量会将PCl3氧化生成PCl5,根据表,随PCl3是液态,PCl5是固态,但在加热时温度都超过75℃,此时PCl3是气态,PCl5是液态,可以蒸馏分开;故答案为:蒸馏。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是

A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中c (HCO3-) > c (CO32-)
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、二氧化碳、氧气作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”(碱式碳酸铜),“铜绿”能跟酸反应生成铜盐、二氧化碳和水。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从三种不同分类标准回答,“铜绿”属于物质的类别是____。
(2)请写出铜绿与盐酸反应的化学方程式_____。
(3)写出B的化学式_____。
(4)上述转化过程中属于化合反应的是___,属于复分解反应的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
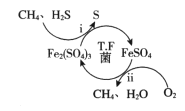
A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]3H2O为绿色晶体,易溶于水,难溶于乙醇、丙酮等有机溶剂。
I.三草酸合铁(Ⅲ)酸钾晶体的制备
①将5g(NH4)2Fe(SO4)2·6H2O晶体溶于20mL水中,加入5滴6 mol·L-1H2SO4酸化,加热溶解,搅拌下加入25mL饱和H2C2O4溶液,加热,静置,待黄色的FeC2O4沉淀完全以后,倾去上层清液,倾析法洗涤沉淀2-3次。
②向沉淀中加入10mL饱和草酸钾溶液,水浴加热至40℃,用滴管缓慢滴加12mL5%H2O2,边加边搅拌并维持在40℃左右,溶液成绿色并有棕色的沉淀生成。
③加热煮沸一段时间后,再分两批共加入8mL饱和H2C2O4溶液(先加5mL,后慢慢滴加3mL)此时棕色沉淀溶解,变为绿色透明溶液。
④向滤液中缓慢加入10mL95%的乙醇,这时如果滤液浑浊可微热使其变清,放置暗处冷却,结晶完全后,抽滤,用少量洗涤剂洗涤晶体两次,抽干,干燥,称量,计算产率。
已知制备过程中涉及的主要反应方程式如下:步骤②6FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3,步骤③2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O,请回答下列各题:
(1)简述倾析法的适用范围______________,步骤③加热煮沸的目的是_______________。
(2)下列物质中最适合作为晶体洗涤剂的是____________________(填编号)。
A.冷水 B.丙酮 C.95%的乙醇 D.无水乙醇
(3)有关抽滤如图,下列说法正确的是_____________。

A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.右图所示的抽滤装置中,只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
Ⅱ.纯度的测定
称取1.000g产品,配制成250mL溶液,移取25.00mL溶液,酸化后用标定浓度为0.01000 mol·L-1的高锰酸钾溶液滴定至终点,三次平行实验平均消耗高锰酸钾溶液24.00mL。
(4)滴定涉及反应的离子方程式:___________________________________。
(5)计算产品的纯度_____________________(用质量百分数表示)。(K3[Fe(C2O4)3]·3H2O的相对分子质量为491)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O IO![]() →I2 MnO
→I2 MnO![]() →Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
→Mn2+ HNO2→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A. H2O2 B. HNO2 C. MnO![]() D. IO
D. IO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是

A. 开始时产生的气体为H2
B. AB段发生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5 mol·L—1
D. 参加反应铁粉的总质量m2=5.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极![]() 接通电源,经过一段时间后,乙中c电极质量增加
接通电源,经过一段时间后,乙中c电极质量增加![]() 据此回答问题:
据此回答问题:
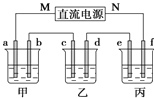
(1)电源的M端为_____________极;
(2)电极d上发生的电极反应式为__________; 乙池溶液PH__________填(“增大”、“减小”或“不变”)
(3)甲池中的总反应式为___________________________________;
(4)当电路中有0.04mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是____________;
(5)若利用丙池实现铁上镀铜,则“e-f-x”![]() 溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
(6) 实验测得, 1g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____________________________________________________
(7)亚硝酸氯![]() 结构式为
结构式为![]() 是有机合成中的重要试剂,可由
是有机合成中的重要试剂,可由![]() 和
和![]() 在通常反应条件下制得,反应方程式为
在通常反应条件下制得,反应方程式为![]() 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:
化学键 |
|
|
|
|
键能 | 243 | a | 607 | 630 |
当![]() 与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol·L-1、0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度( mol·L-1)是( )
A. 0.15 B. 0.225 C. 0.35 D. 0.45
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com