
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
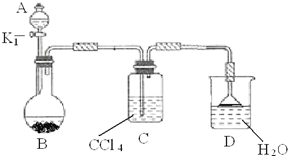 以下为苯的取代反应的探究实验.
以下为苯的取代反应的探究实验.| 试剂 |
| 操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据废水中所含有害物质的不同,工业上有多种废水的处理方法.
根据废水中所含有害物质的不同,工业上有多种废水的处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:
 结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )
结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )| A、6 | B、9 | C、12 | D、15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )
以葡萄糖为燃料的微生物燃料电池如图所示.关于该电池的叙述正确的是( )| A、该电池能够在高温下工作 |
| B、电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| C、放电过程中,将生成的CO2和水随时排出,保持电解质浓度恒定 |
| D、在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO222.4/6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷、乙酸乙酯在一定条件下都能与NaOH水溶液发生反应 |
| B、煎炸食物的花生油和猪油都是可皂化的饱和酯类 |
| C、裂化汽油、植物油均能使溴的四氯化碳溶液褪色 |
| D、用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com