
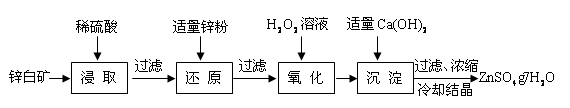
 Fe(OH)3��3H�� ,д��ƽ�ⳣ��K= c3(H+)/c(Fe3+) ��Ca(OH)2���ܹ�����ԭ���ǣ�Fe3�� ��pHΪ1.1�D3.2ʱ������pH��5.9�D8.9ʱZn2�� �������𰸣�c3(H+)/c(Fe3+)����ֹ����Zn(OH)2��
Fe(OH)3��3H�� ,д��ƽ�ⳣ��K= c3(H+)/c(Fe3+) ��Ca(OH)2���ܹ�����ԭ���ǣ�Fe3�� ��pHΪ1.1�D3.2ʱ������pH��5.9�D8.9ʱZn2�� �������𰸣�c3(H+)/c(Fe3+)����ֹ����Zn(OH)2��

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��4����ҺpH�Ĵ�С˳��>��>��>�� |
| B��������Ģٺ͢���Һ��Ϻ�pH>7��c(NH3��H2O)>c( NH4��) |
| C����Һ�١�����ˮ���������c(OH�D )����<�� |
| D����Һ�ۡ��ܵ������Ϻ���Һ��c(CO32��)>c(HCO3) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Ũ�Ⱦ�Ϊ0.1mol?L��1��CH3COOH��CH3COONa��Һ�����������õ���Һ�У� c(CH3COOH)+c(CH3COO��)=0.2mol?L-1 |
| B��0.1mol?L-1NaHCO3��Һ�У�c(Na+)=c(HCO3-)+c(H2CO3)+2(CO32-) |
| C��0.2mol?L-1HCl��Һ������0.1mol?L-1NaOH��Һ��Ϻ���Һ��pH=1 |
| D��0.1mol?L-1��ˮ�е���0.1mol?L-1��������Һ������ʱ�������Һ�У�c(NH4+)=c(Cl��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
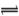 X2��+H+���ش��������⣺
X2��+H+���ش��������⣺ ��2����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L��1��FeCl3��AlCl3�����Һ����μ��백ˮ�������� ���ѧʽ����������֪25��ʱKsp[Fe(OH)3]=2.6��10��39 mol4��L��4��KsP[Al(OH)3]=1.3��10��33 mol4��L��4��
��2����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L��1��FeCl3��AlCl3�����Һ����μ��백ˮ�������� ���ѧʽ����������֪25��ʱKsp[Fe(OH)3]=2.6��10��39 mol4��L��4��KsP[Al(OH)3]=1.3��10��33 mol4��L��4���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 �����ӣ��辭��ˮ������������ŷţ���ˮ�����������������̽��д�����
�����ӣ��辭��ˮ������������ŷţ���ˮ�����������������̽��д�����
 SO42����Cr3����H2O��δ��ƽ������ÿ����0.4mol Cr2O72��ת��__________mol e-��
SO42����Cr3����H2O��δ��ƽ������ÿ����0.4mol Cr2O72��ת��__________mol e-���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����֪I3�� I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4�����Ϻ�ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
B����������10mL pH =3�Ĵ�����Һ�м�ˮϡ�ͺ�,��Һ��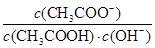 ��С ��С |
| C������ʱka(HF)��3.6��10��4��ka(CH3COOH)��1.75��10��5��0.1 mol /L��NaF��Һ��0.1 mol /L��CH3COOK��Һ���,һ����c(Na��) ��c(F��)��c(K��)��c(CH3COO��)���� |
D����25��ʱ����amol/L�İ�ˮ��0.01 mol/L������������ϣ���ַ�Ӧ����Һ��c(NH4��)��c(Cl��)����25��ʱNH3 ? H2O�ĵ��볣��Kb��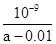 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
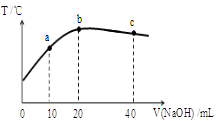
| A������ĵ���ƽ�ⳣ����b�㣾a�� |
| B����ˮ�������c(OH��)��b�㣾c�� |
| C����a�㵽b�㣬�����Һ�п��ܴ��ڣ�c(CH3COO��)= c(Na+) |
| D��b�㵽c�㣬�����Һ��һֱ���ڣ�c(Na+)��c(CH3COO��)��c(OH��)��c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��FeO����ϡ�����У�FeO+2H+ = Fe2++H2O |
| B������CO2ͨ��NaOH��Һ�У�OH¯+CO2 = HCO3¯ |
| C������������ˮ�У�Na+H2O = Na++OH¯+H2�� |
| D��������ˮ����AlCl3��Һ�У�Al3++3OH¯= Al(OH)3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH=1����Һ�У�Fe3+��NO3-��Cl-��Na+ |
| B����ˮ�����c(H+)=10-12mol��L��1����Һ�У�Cl����CO32����K+��SO32�� |
| C��c(OH��)/c(H+)��1012����Һ�У�SO32����NH4����NO3����K�� |
| D����ʹ���ȳʺ�ɫ����Һ�У�Na+��AlO2����NO3����HCO3�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com