
 2SO3(g)
2SO3(g)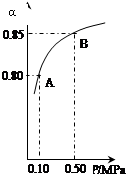
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/mol·L—1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
科目:高中化学 来源:不详 题型:单选题
 2C(g)若开始时只充入2molC(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molA和1molB的混合气体,达平衡时A的转化率为( )
2C(g)若开始时只充入2molC(g),达平衡时,混合气体的压强比起始时增加20%,若开始时只充入2molA和1molB的混合气体,达平衡时A的转化率为( ) | A.20% | B.40% | C.60% | D.80% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3C(g)+2D(g),达到平衡状态的是
3C(g)+2D(g),达到平衡状态的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Z(g)+2W(g) △H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2W(g) △H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是| A.5s内平均反应速率为υ(Y)=" 0.2" mol/( L·s) |
| B.该反应的平衡常数数值为0.5 |
| C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率 |
| D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.黄绿色的氯水光照后颜色变浅 |
| B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质 |
| C.生产硝酸的过程中使用过量空气以提高氨气的利用率 |
| D.实验室常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+ |
| C.选择合适的催化剂可使水在较低温度下分解 |
| D.滴有酚酞的Na2CO3溶液,加热后颜色变深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g) +2D(g),2 min 末反应达到平衡状态,生成0.8 mol D,请填写下面空白:
2C(g) +2D(g),2 min 末反应达到平衡状态,生成0.8 mol D,请填写下面空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) △H=―190 kJ·mol—1
2SO3(g) △H=―190 kJ·mol—1 的是_______________。(填字母)
的是_______________。(填字母)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com