
����Ŀ��������ͼװ�ý����Ҵ��Ĵ�����ʵ�鲢��ȡ��ȩ���Թܱ�����ˮ���ղ����
����д���пհף�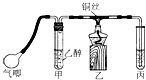
��1��������ȩ���Լ�������ѡ���ţ�
a��������Һ b��̼��������Һ c������������ͭ d������ͭ
�Ҵ������������Ļ�ѧ��Ӧ����ʽΪ��
��2��ʵ�鿪ʼʱ�����ȹ�����������ȵ�ȼ�ƾ��Ƽ���ͭ˿�� �� ԭ��������ʵ���С������ٶȡ���һ��������Ϊ������������
��3��ʵ��ʱ����������װ�ý���70�桫80���ˮԡ�У�Ŀ���� �� ����ʵ����Ҫˮԡ���ȵ�������ѡ���ţ�
a��±����ˮ�� b��������Ӧ c�����ᶡ�� d������������Ӧ
��4���ÿ���С��żȻ��������ˮ�м�����ȩ��Һ����ˮ��ɫ����������ǡ����ȫ��Ӧ������ͬѧΪ������������������ֲ��룺����ˮ����ȩ����Ϊ�������ˮ����ȩ�����ӳɷ�Ӧ���������һ����ʵ�飬̽����һ�ֲ�����ȷ�� ��
���𰸡�
��1��ac����2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
��2���ȵ�ȼ�ƾ��Ƽ���ͭ˿���Ȳ�������ͭʹ�Ҵ���Ӧ����֣���λʱ���ڼ��е�������
��3��ʹ�����Ҵ����������ʼӿ��ҽϾ��ȣ�bd
��4����pH��ֽ�����ˮ����ɫ����Һ������ԣ�������������ǿ����������ȷ����֮���������ȷ
�������� �⣺��1����ȩ����ȩ�����ܹ�����������Ӧ�������Ƶ�������ͭ��Ӧ����ש��ɫ����������ͨ����������Һ�����Ƶ�������ͭ���飻�Ҵ�������������ȩ��ˮ����ѧ����ʽ��2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O���ʴ�Ϊ��ac��2CH3CH2OH+O2
2CH3CHO+2H2O���ʴ�Ϊ��ac��2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O����2��ͭ��������Ӧ��������ͭ������ͭ���Ҵ���Ӧ������ȩ���ȵ�ȼ�ƾ��Ƽ���ͭ˿��������ͭ���ܹ�ʹ�Ҵ�����ֵķ�Ӧ����ʵ���С������ٶȡ���һ��������Ϊ���õ�λʱ���ڼ��е������������⣻�ʴ�Ϊ���ȵ�ȼ�ƾ��Ƽ���ͭ˿���Ȳ�������ͭʹ�Ҵ���Ӧ����֣���λʱ���ڼ��е��������� ��3������װ�ý���70�桫80���ˮԡ�У�ʹ�����Ҵ����������ʼӿ��ҽϾ��ȣ�ˮԡ�����¶�ΪС��100�ȣ�
2CH3CHO+2H2O����2��ͭ��������Ӧ��������ͭ������ͭ���Ҵ���Ӧ������ȩ���ȵ�ȼ�ƾ��Ƽ���ͭ˿��������ͭ���ܹ�ʹ�Ҵ�����ֵķ�Ӧ����ʵ���С������ٶȡ���һ��������Ϊ���õ�λʱ���ڼ��е������������⣻�ʴ�Ϊ���ȵ�ȼ�ƾ��Ƽ���ͭ˿���Ȳ�������ͭʹ�Ҵ���Ӧ����֣���λʱ���ڼ��е��������� ��3������װ�ý���70�桫80���ˮԡ�У�ʹ�����Ҵ����������ʼӿ��ҽϾ��ȣ�ˮԡ�����¶�ΪС��100�ȣ�
a��±����ˮ�ⷴӦ����Ϊ���ȣ�����Ҫˮԡ���ȣ��ʲ�ѡ��b��������Ӧ��Ҫ���¶Ȳ�����100�棬�ʿ�����ˮԡ���ȣ���bѡ�� c����ȡ����������Ҫ���¶Ƚϸߣ���Ҫ�þƾ���ֱ�Ӽ��ȣ�������ˮԡ���ȣ���C��ѡ��d������Ũ���ᡢŨ������50�桫60�淢��������Ӧ������������ˮ��Ӧ��ˮԡ���ȣ���dѡ����ѡ��bd����4����ȩ���л�ԭ�ԣ���ȩ����ˮ�������������HBr����Һ�����ԣ���ȩ�����к��в����ͼ�����ˮ��������ȩ�����ӳɷ�Ӧ��û��HBr���ɣ���Һ�������ԣ����Լ�����ɫ����Һ������ԣ�ȷ���䷢�����෴Ӧ���ʴ�Ϊ����pH��ֽ�����ˮ����ɫ����Һ������ԣ�������������ǿ����������ȷ����֮�������ȷ��
��1������ȩ���������ܹ�����������Ӧ���ܹ������Ƶ�������ͭ��Ӧ��
�Ҵ�������������ȩ��ˮ����2��ͭ��������Ӧ��������ͭ������ͭ���Ҵ���Ӧ������ȩ���ȵ�ȼ�ƾ��Ƽ���ͭ˿��������ͭ���ܹ�ʹ�Ҵ�����ֵķ�Ӧ����ʵ���С������ٶȡ���һ��������Ϊ���õ�λʱ���ڼ��е������������⣻��3��ˮԡ���ȿ������Ҵ���һ�����¶��³�Ϊ�������Ӷ��ӿ췴Ӧ�����ʣ����ݷ�Ӧ�����жϽ�𣻣�4��������ȩ������������������廯�����ɣ���Һ��ǿ���ԣ����Ƿ����ӳɷ�Ӧ�������ɱ��ͺ����л����Һ��Ϊ���ԣ��ʿ��������ָʾ����ȷ�����ֲ�������ȷ�ģ�


 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LiFePO4��ؾ����ȶ��Ըߡ���ȫ���Ի����Ѻõ��ŵ㣮ij�缫�Ĺ���ԭ����ͼ1��ʾ���õ�ص����Ϊ�ܴ��� Li+�Ĺ�����ϣ�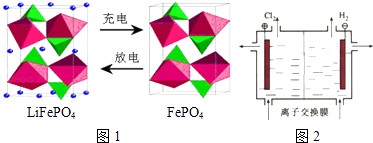
��1���ŵ�ʱ���õ缫Ϊ�����缫��ӦΪ
��2�����ʱ�õ缫������ӵ�Դ����
��3���ŵ�ʱ����ظ��������������١����ӡ����䣩
��4��LiOH�����Ʊ�����ӵ�ص缫�IJ��ϣ�������ͼ2װ�õ���Ʊ�LiOH�����缫�����Һ�ֱ�ΪLiOH��LiCl��Һ�����������ҺΪ��Һ���ѧʽ�������ӽ���ĤӦʹ���������������ӽ���Ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ��һ����;�㷺�Ļ���ԭ�ϣ�ʵ�����Է�ͭмΪԭ����ȡ��ʽ̼��ͭ�IJ������£�
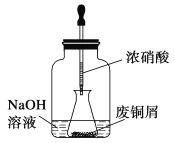
����һ����ͭм������ͭ
��ͼ���ý�ͷ�ι���ȡŨ���Ỻ���ӵ���ƿ�ڵķ�ͭм��(��ͭм����)����ַ�Ӧ����ˣ��õ�����ͭ��Һ��
���������ʽ̼��ͭ���Ʊ�
����Թ��м���̼������Һ������ͭ��Һ��ˮԡ������70 �����ң���0.4 mol��L��1��NaOH��Һ����pH��8.5�������ã����ˣ�����ˮϴ�ӣ���ɣ��õ���ʽ̼��ͭ��Ʒ��
���������գ�
(1)д��Ũ������ͭ��Ӧ�����ӷ���ʽ___________________________________________��
(2)��ͼװ����NaOH��Һ��������_________________________��
(3)������У�ˮԡ��������������________��________(���ȡ��г�������ʯ��������)��ˮԡ���ȵ��ŵ���_______________________��
(4) ��֪��CuCO3��Cu(OH)2���Ⱦ��ֽ⣬�����ж���CuO���ɡ���ʽ̼��ͭ�ɱ�ʾΪxCuCO3��yCu(OH)2��zH2O��x��y��zȡ���������ⶨ��ʽ̼��ͭ��ɵķ����ж��֣��ֲ���������ԭ������ش��������⣺����֪M��Cu����63.5 g��mol��1����
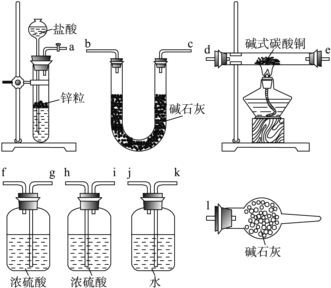
��д��xCuCO3��yCu��OH��2��zH2O��������Ӧ�Ļ�ѧ����ʽ��__________________��
��ʵ��װ�������������������Ӷ��ɣ������������������˳���ǣ����������ӿ���ĸ��ţ����� a ������ ���� ������ ���� ������ ���� ������ ���� ������ ���� ������ l ��_____
�۳�ȡ23.9 gij��ʽ̼��ͭ��Ʒ����ַ�Ӧ��õ�12.7 g���������4.4 g������̼��7.2 gˮ������Ʒ�Ľᾧˮ����Ϊ______ g����ѧʽΪ____________��
��ijͬѧ�Ե���������������������ȫ�����������ⶨ��ʽ̼��ͭ����ɣ�����Ϊ�Ƿ���У�__________������С������С�����˵������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п����������þ���ֽ�����������ɵĻ����10�ˣ������������ᷴӦ�����������ڱ�״����Ϊ11.2L����������һ�����еĽ�����( )
A. п B. �� C. �� D. þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��ȷ���ǣ� ��
A. MgSO4=Mg��2��SO4-2
B. Ba(OH)2=Ba2����OH2-
C. Al2(SO4)3=2Al3����3SO42-
D. KClO3=K����Cl����3O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��R���ӵ�����Ϊa g���������ΪM����M��a�ı�ֵ���ڣ� ��
A.6.02��1023
B.12Cԭ��������ʮ����֮һ
C.0.012Kg12C������ԭ����
D.1mol��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������м��ȡĪ���ε���Ҫ�����ǣ�����м��ϡ����ˮԡ������ȡFeSO4��FeSO4��(NH4)2SO4�Ե����ʵ�����Ϻ���ȣ�Ũ���ᾧ��Ī���Ρ�
��1��������м��ϡ����ʱ������Ҫ��������ˮ��ԭ����
��2��ʵ����Ϊ����������������ʧ�����˷�������������ҺʱӦע�����������
��3��Ϊ��ֹFe2����������ʵ���пɲ�ȡ�Ĵ�ʩ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ�������£�һ���ܴ���������ǣ� ��
A.��ʹ��ɫʯ����ֽ���ɫ����Һ�У�K+��Na+��CO ![]() ��NO
��NO ![]()
B.c��H+��=1��10��1mol?L��1����Һ�У�Cu2+��A13+��SO ![]() ��NO
��NO ![]()
C.��ʹ�⻯�ص�����ֽ��������Һ�У�Na+��NH ![]() ��S2����Br��
��S2����Br��
D.ˮ�������c��H+��Ϊ1��10��12 mol?L��1����Һ�У�Na+��Mg2+��Cl����SO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ڵ���ʵ����� ��
A. ���� B. NaCl C. ���� D. SO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com