
【题目】过氧化尿素是一种新型漂白剂、消毒剂、漂白、消毒的效果优于H2O2和过氧乙酸。某工业用过氧化尿素的部分参数见下表:
分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 500g·L-1 |
合成过氧化尿素的步骤及反应器的示意图如下:在250mL三颈烧瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不断搅拌下升温至300℃,使尿素完全溶解,保温30min,冷却至-5℃进行结晶。抽滤得白色粉末状结晶。在50℃下干燥2h,得过氧化尿素产品。回答下列问题:
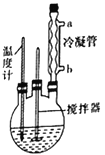
(1)控制反应温度的适宜方法是__________ (填序号)。
A.酒精灯加热 B.酒精喷灯加热 C.电炉加热 D.水浴加热
(2)反应器中发生反应的化学方程式为___________________________________。
(3)反应器中冷凝管中冷水从______(填“a”或“b”)流进;反应器加热温度不能太高的原因是___________。
(4)搅拌器不能选择铁质或铝质材料的原因是_______________________________________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于含H2O234%),称取干燥样品12.000g,溶解,在250mL 容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:
实验序号 | 1 | 2 | 3 | |
KMnO4溶液体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
滴定后读数 | 19.98 | 21.70 | 22.02 | |
①KMnO4溶液应盛放在__________滴定管中,滴定终点的现象是_____________。
②产品中活性氧的质量分数为____________。
③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会使测得的活性氧含量__________(填“偏高”“偏低”或“不变”)。
【答案】 D CO(NH2)2+H2O2=CO(NH2)2·H2O2 b 温度过高会导致过氧化氢分解 铝、铁易被氧化 酸式 滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色 13.3% 偏低
【解析】试题分析: (1)根据CO(NH2)2·H2O2热分解温度为45℃,分析加热方式;(2)反应器中过氧化氢与尿素发生化合反应生成CO(NH2)2·H2O2;(3) 冷凝管中冷水要低进高出;温度太高,过氧化氢会分解;(4)铁、铝具有还原性,易被氧化;(5)①高锰酸钾具有氧化性,能腐蚀橡胶;H2O2与高锰酸钾溶液反应,使高锰酸钾溶液褪色;②依据2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;计算过氧化氢物质的量,结合题干信息计算产品中活性氧的质量分数;③依据c标准×V标准=c待测×V待测,根据标准液消耗的多少分析判断;
解析:(1)根据CO(NH2)2·H2O2热分解温度为45℃,所以采用的加热方式应用水浴加热,易于控制温度,选D;(2)反应器中过氧化氢与尿素发生化合反应生成CO(NH2)2·H2O2,反应的化学方程式为CO(NH2)2+H2O2=CO(NH2)2·H2O2;(3) 冷凝管中冷水要低进高出,所以冷凝管中冷水从b流进;过氧化氢加热会分解,所以温度不能太高;(4)铁、铝具有还原性,易被氧化,所以不能选择铁质或铝质材料搅拌器;(5)①高锰酸钾具有氧化性,腐蚀橡胶,KMnO4溶液应盛放在酸式滴定管中;H2O2与高锰酸钾溶液反应,使高锰酸钾溶液褪色,滴定终点的现象是滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色;②第二次实验明显误差太大,应舍去,第一次和第三次滴定平均消耗KMnO4溶液20.00mL;依据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;
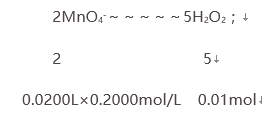
所以12.000g样品中含过氧化氢0.1mol;过氧化氢质量分数=![]() ×100%=28.3%;活性氧16%,相当于H2O234%,则活性氧质量分数=
×100%=28.3%;活性氧16%,相当于H2O234%,则活性氧质量分数=![]() =13.3%,;③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,消耗高锰酸钾溶液偏小,依据c标准×V标准=c待测×V待测,则过氧化氢物质的量偏小,活性氧含量偏低。
=13.3%,;③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,消耗高锰酸钾溶液偏小,依据c标准×V标准=c待测×V待测,则过氧化氢物质的量偏小,活性氧含量偏低。


科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的锌粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH溶液 ②H2O ③CH3COONa固体 ④NaNO3溶液⑤稀硫酸
A.②③ B.②④ C.②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
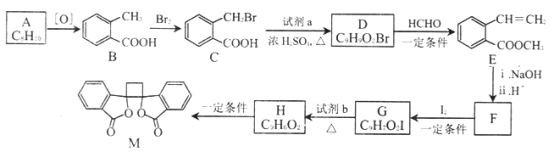
【题目】有机物M 有抗菌作用,其合成路线如下图所示:
已知:
①RCH2Br R-HC=CH-R
R-HC=CH-R
②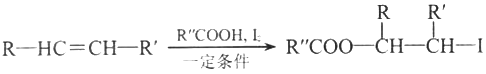
③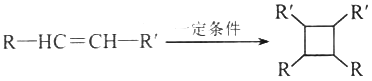
(以上R、R'、R”代表氢、烷基或芳基等)
(1)A的结构简式是___________。
(2)B 的名称是__________,M 中的官能团名称是__________ 。
(3)分别写出B-C、G-H 的反应类型__________ 、__________ 。
(4)写出C-D 的化学方程式__________________。
(5)E 的同分异构体中,符合下列条件的结构共有_______种。
①苯的二元取代物 ②与E 具有相同的官能团 ③能发生银镜反应和水解反应
(6)由F 与I在一定条件下反应生成G 的化学方程式是__________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物实验中,可以根据与某些化学试剂所产生的颜色反应,检测生物组织中的有关有机化合物的存在。在下列实验列表中,正确的是( )
选项 | 待检测的物质 | 使用试剂 | 呈现颜色 |
A | 苹果中的还原糖 | 斐林试剂 | 橘黄色 |
B | 马铃薯中的淀粉 | 双缩脲试剂 | 蓝色 |
C | 花生的脂肪 | 苏丹Ⅲ染液 | 橘黄色 |
D | 大豆中的蛋白质 | 斐林试剂 | 紫色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.只有化学键形成的变化不一定是化学变化
B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素
C.若两种元素原子的最外层电子数相同,则两元素的最高正价不一定相同
D.锂(Li)能在氧气中剧烈燃烧,产物是Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的核外电子排布式为________,其排布时能量最高电子所占据能级的原子轨道有________个伸展方向。
(2)VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有____(写元素符号)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______,与CN-互为等电子体的一种分子的化学式为__________。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为________。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为__________。

(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为____。
(6)镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为___________。
②该镧镍合金储氢后氢气的密度为________(用NA表示阿伏加德罗常数的数值)g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的说法正确的是( )
A.化学反应常伴随能量的变化
B.反应条件是加热的反应都是吸热反应
C.放热反应都不需要加热就能发生
D.化学反应中的能量变化仅有热量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=5的H2SO4的溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为( )
A. 1∶1 B. 1∶2 C. 1∶10 D. 1∶20
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com