
科目:高中化学 来源: 题型:
| X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是其周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578kJ?mol-1;I2=1817kJ?mol-1;I3=2745kJ?mol-1; I4=11575kJ?mol-1 ;I5=14830kJ?mol-1 ;I6=18376kJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| 元素R位于周期表的第10列 |

查看答案和解析>>
科目:高中化学 来源: 题型:
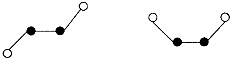
2+ 0.45 |
3+ 0.5 |
2+ 0.25 |
3+ 0.70 |
2+ 0.15 |
3+ 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z的基态原子价电子排布为ns2npn+2 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为65,中子数为36 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省西安市高三第一次质检化学试卷(解析版) 题型:推断题
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大。W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍。请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为 。在上述三种元素的原子中,写出与WZ2互为等电子体的分子式 。
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)

该分子中Y原子的杂化方式是 杂化。
(3)W2-2阴离子的电子式为 ,Z原子最外层电子排布式为 。
(4)YQ3分子的空间构型为 ,Y和Q两元素的氢化物的沸点相比较,高者是 (写分子式).往硫酸铜溶液中通入过量的YH3(Y的氢化物分子式),可生成配离子[Cu(YH3)4]2+,但YQ3不易与Cu2+形成配离子,其原因是 。
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似。那么在RZ晶体中距离R2+最近且等距离的R2+有 个。若在RZ晶体中阴阳离子间最近距离为a cm,晶体密度为ρg/cm3,则阿伏伽德罗常数NA的表达式为 mol-1。
(6)已知非整数比化合物R0.95Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷。R0.95Z可表示为( )

查看答案和解析>>
科目:高中化学 来源:2010-2011学年安徽省名校高三联考(理综)化学部分 题型:填空题
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其相关信息如下表:
|
元素 |
相关信息 |
|
T |
T原子所处的周期数、族序数分别与其原子序数相等 |
|
X |
X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
|
Z |
Z的基态原子价电子排布为 |
|
Q |
在该元素所在周期中,Q的基态原子的第一电离能最小 |
|
R |
3p能级上有1个电子 |
|
W |
W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是 (用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,其硬度比金刚石大,则X3Y4晶体中含有 键(填“共价”、“离子”、“金属”),属于 晶体(填“分子”、“原子”、“离子”)。
(3)W的基态原子的核外电子排布式为 。利用电解可提纯W物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 。
(4)T、X两种元素组成的一种化合物M是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则M分子中 键和
键和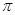 键的个数比为 。在T—Y、T—Z两种共价键中,键长较长的是
。
键的个数比为 。在T—Y、T—Z两种共价键中,键长较长的是
。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2834.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com