
 有A、B、C、D四中元素,其中A的基态原子核外电子有11中运动状态,B的基态原子得一个电子喉3p轨道就处于全充满状态,C的最常见气态氢化物呈碱性,D与A能形成离子化合物A2D且D2-比A+多一个电子层.
有A、B、C、D四中元素,其中A的基态原子核外电子有11中运动状态,B的基态原子得一个电子喉3p轨道就处于全充满状态,C的最常见气态氢化物呈碱性,D与A能形成离子化合物A2D且D2-比A+多一个电子层.| 6+2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| ρ |
| 4×78 |
| ρNA |
| 3 |
| ||
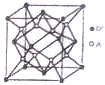
 钠离子位于正四面体的体心上,四个氧原子位于正四面体的顶点上,钠原子位于体心上,正四面体的棱长=
钠离子位于正四面体的体心上,四个氧原子位于正四面体的顶点上,钠原子位于体心上,正四面体的棱长=
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
| 2 |
| 3 |
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
| ||
| 6 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| 6 |
| 3 |
| ||
| ||
| 6 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、导电性很强的物质,在任何情况下均能导电 |
| B、在溶于水或熔融状态下能导电的化合物 |
| C、在溶于水或熔融状态下全部电离的化合物 |
| D、可溶性盐类、酸类和碱类等化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
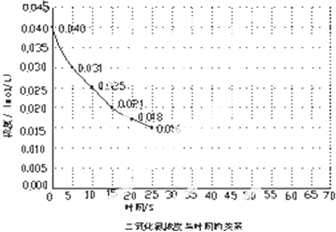
 科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质.
科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质. 代表氢原子,
代表氢原子, 代表碳原子)和水,该有机物的结构简式为
代表碳原子)和水,该有机物的结构简式为 ,该烷烃的名称为
,该烷烃的名称为查看答案和解析>>
科目:高中化学 来源: 题型:
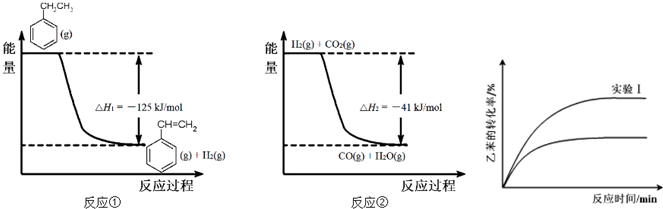
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)的△H=
(g)+CO(g)+H2O(g)的△H= )的影响,并设计了如下实验:
)的影响,并设计了如下实验:| 试验编号 | 乙苯 | CO(g)/mol | H(g)/mol | 温度/℃ |
| Ⅰ | 3.0 | 9.0 | 0 | 550 |
| Ⅱ | 3.0 | 9.0 | 0 | 600 |
| Ⅲ | 3.0 | 0 | 9.0 | 550 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com