
【题目】成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A. 木已成舟 B. 铁杵成针 C. 蜡炬成灰 D. 滴水成冰
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) + yB(g)![]() zC(g)平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是 ( )
zC(g)平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断正确的是 ( )
A. x + y < z B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
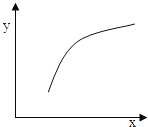
A. x表示温度,y表示容器内混合气体的密度
B. x表示CO的物质的量,y表示CO2与CO的物质的量之比
C. x表示SO2的浓度,y表示平衡常数K
D. x表示MgSO4的质量(忽略体积),y表示CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化工厂铬渣中提取硫酸钠的工艺如下:
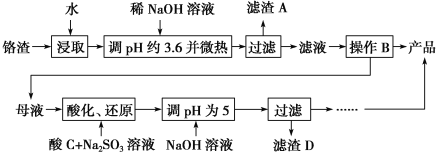
已知:①铬渣含有Na2SO4及少量Cr2O![]() 、Fe3+;
、Fe3+;
②Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以________________________,滤渣A为________(填化学式)。
(2)根据溶解度(S)~温度(T)曲线,操作B的最佳方法为________(填字母序号)。
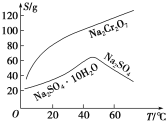
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O![]() 可被SO
可被SO![]() 还原成Cr3+,离子方程式为_____________________;
还原成Cr3+,离子方程式为_____________________;
酸C为______________,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=____________。
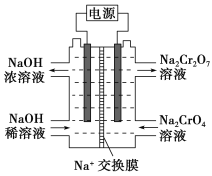
(4)根据2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的________极,其电极反应式为____________________________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的________极,其电极反应式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知碳单质的燃烧热为-393.5 kJmol-1,CO的燃烧热为-283kJmol-1,写出碳不完全燃烧生成CO的热化学方程式______________________________________。
(2)以CO为燃料,可以制成燃料电池。以CO为燃料,熔融碳酸盐为电解质的燃料电池正极通入的气体是_____________,负极的电极反应式____________________________。
(3)CO是汽车尾气之一,严重污染空气,在汽车上安装尾气处理器,发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
现在固定容积为2L的密闭容器中通入NO和CO各2mol发生上述反应,随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
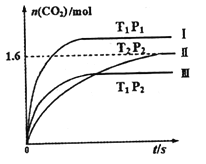
①曲线I、II、III对应反应从开始到平衡时用CO2表示的平均反应速率分别为V(I)、V(II)、V(III),则三者大小关系为______________。
②该反应△H__________0(填“>”、“=”或“<”);曲线II对应平衡常数K=_________;
曲线II对应的反应达平衡后,再通入2molNO和2molCO并保持温度不变,则再达平衡时NO的转化率将_______(填“增大”、“减小”或“不变”)。
③若维持温度为T2压强为P2的条件下,按下列四种方法改变起始物质的用量,达到平衡后,CO2的浓度为0.8 mol·L-1的是______________________________。
A.4mol NO+4 mol CO B.2 mol N2+2 mol CO2
C.1mol NO+1mol CO+1 mol N2+2 mol CO2 D.1mol NO+2mol N2+2 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各基态原子或离子的电子排布式错误的是( )
A. Al 1s22s22p63s23p1 B. S2- 1s22s22p63s23p6
C. Cu [Ar]3d94s2 D. Ca [Ar] 4s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25 L2/mol2
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com