
【题目】从化工厂铬渣中提取硫酸钠的工艺如下:
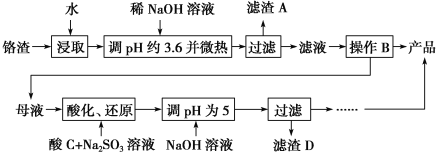
已知:①铬渣含有Na2SO4及少量Cr2O![]() 、Fe3+;
、Fe3+;
②Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以________________________,滤渣A为________(填化学式)。
(2)根据溶解度(S)~温度(T)曲线,操作B的最佳方法为________(填字母序号)。
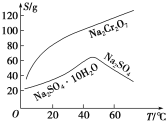
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O![]() 可被SO
可被SO![]() 还原成Cr3+,离子方程式为_____________________;
还原成Cr3+,离子方程式为_____________________;
酸C为______________,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=____________。
(4)根据2CrO![]() +2H+
+2H+![]() Cr2O
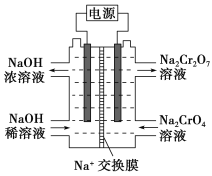
Cr2O![]() +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的________极,其电极反应式为____________________________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的________极,其电极反应式为____________________________。
【答案】(1)促进Fe3+水解生成Fe(OH)3而除去 Fe(OH)3
(2)A
(3)3SO![]() +Cr2O
+Cr2O![]() +8H+===2Cr3++3SO
+8H+===2Cr3++3SO![]() +4H2O H2SO4 1.0×10-32
+4H2O H2SO4 1.0×10-32
(4)正 4OH--4e-===O2↑+2H2O
【解析】(1)由信息知pH约3.6时可除去Fe3+,加热促进Fe3+水解,滤渣A是Fe(OH)3沉淀。(2)由图像知Na2SO4的溶解度在45 ℃左右最大,而Na2Cr2O7的溶解度随温度的升高不断变大,所以蒸发浓缩后趁热过滤可得到Na2SO4固体。(3)该反应的氧化剂是Cr2O![]() ,还原产物是Cr3+,还原剂是SO
,还原产物是Cr3+,还原剂是SO![]() ,氧化产物是SO
,氧化产物是SO![]() ,由得失电子守恒可知n(Cr2O
,由得失电子守恒可知n(Cr2O![]() )∶n(SO
)∶n(SO![]() )=1∶3,最后根据质量守恒和电荷守恒配平。为了不引入其他杂质,应加H2SO4酸化。pH=5时,Cr3+完全沉淀,c(Cr3+)=1.0×10-5 mol·L-1,c(OH-)=10-9mol·L-1,Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)=1.0×10-5×(10-9)3=1.0×10-32。(4)由图可知Na2CrO4发生反应生成Na2Cr2O7,所以在该电极产生了大量的H+,而在另一极NaOH由稀到浓可知产生了大量的OH-,所以右侧电极是阳极,OH-失去电子发生氧化反应生成H2O和O2,所以连接电源的正极。
)=1∶3,最后根据质量守恒和电荷守恒配平。为了不引入其他杂质,应加H2SO4酸化。pH=5时,Cr3+完全沉淀,c(Cr3+)=1.0×10-5 mol·L-1,c(OH-)=10-9mol·L-1,Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)=1.0×10-5×(10-9)3=1.0×10-32。(4)由图可知Na2CrO4发生反应生成Na2Cr2O7,所以在该电极产生了大量的H+,而在另一极NaOH由稀到浓可知产生了大量的OH-,所以右侧电极是阳极,OH-失去电子发生氧化反应生成H2O和O2,所以连接电源的正极。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氧元素有16O,17O,18O三种核素,下列对18O 的叙述正确的是
A. 质子数为10 B. 质量数为18
C. 电子数为18 D. 中子数为18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y ![]() 2Z,其平衡常数为1 600(mol/L) -2
2Z,其平衡常数为1 600(mol/L) -2
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:
N2O4(g)![]() 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧ C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A. 木已成舟 B. 铁杵成针 C. 蜡炬成灰 D. 滴水成冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=________。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的主要离子方程式为_______________________________________,由水电离出的
c(OH-)=________mol·L-1。
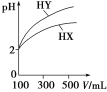
(3)体积均为100 mL、pH均为2的一元酸HX、HY,加水稀释过程中pH与溶液体积的关系如图所示,则HX是________(填“强酸”或“弱酸”),理由是_________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为______________________(填化学式)。
②25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com