
����Ŀ��ˮ�Ǽ����ĵ���ʣ��ı��¶Ȼ����ijЩ����ʻ�Ӱ��ˮ�ĵ��롣��ش��������⣺
(1)��ˮ��100 ��ʱ��pH��6�����¶���0.1 mol��L��1��NaOH��Һ��pH��________��
(2)25 ��ʱ����ˮ�м�������̼���ƹ��壬�õ�pHΪ11����Һ����ˮ�����Ҫ���ӷ���ʽΪ_______________________________________����ˮ�������
c(OH��)��________mol��L��1��
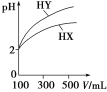
(3)�����Ϊ100 mL��pH��Ϊ2��һԪ��HX��HY����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����HX��________(�ǿ�ᡱ�����ᡱ)��������_________________________��
(4)����ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ��������������֪��
��ѧʽ | ����ƽ�ⳣ��(25 ��) |
HCN | K��4.9��10��10 |
CH3COOH | K��1.8��10��5 |
H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25 ��ʱ����Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ����Һ��pH�ɴ�С��˳��Ϊ______________________(�ѧʽ)��
��25 ��ʱ����0.5 mol��L��1�Ĵ�����Һ���ɴ���������c(H��)Լ����ˮ�������c(H��)��________����
���𰸡�(1)11
(2)CO![]() ��H2O
��H2O![]() HCO
HCO![]() ��OH�� 10��3
��OH�� 10��3
(3)���� ϡ����ͬ������һԪ��HX��pH�仯����HY��С��˵��HX���ڵ���ƽ�⣬��HXΪ����
(4)��Na2CO3>NaCN>CH3COONa ��9��108
��������(1)���������֪��c(OH��)��0.1 mol��L��1�����¶��£�Kw��c(H��)��c(OH��)��10��12����c(H��)��10��11mol��L��1��pH��11��(2)̼���ˮ������ӷ���ʽΪCO![]() ��H2O
��H2O![]() HCO
HCO![]() ��OH����pH��11˵��c(H��)��10��11mol��L��1��c(OH��)��
��OH����pH��11˵��c(H��)��10��11mol��L��1��c(OH��)��![]() mol��L��1��10��3mol��L��1����Һ�е�OH��ȫ������ˮ��������ġ�(4)���������Խ�������Ӧ���ε�ˮ��̶�Խ����Խǿ��pHԽ���ɱ�֪���ԣ�CH3COOH>H2CO3>HCN>HCO
mol��L��1��10��3mol��L��1����Һ�е�OH��ȫ������ˮ��������ġ�(4)���������Խ�������Ӧ���ε�ˮ��̶�Խ����Խǿ��pHԽ���ɱ�֪���ԣ�CH3COOH>H2CO3>HCN>HCO![]() ����pH��Na2CO3>NaCN>CH3COONa�����ɴ���ĵ���ƽ�ⳣ���Ķ����K(CH3COOH)��
����pH��Na2CO3>NaCN>CH3COONa�����ɴ���ĵ���ƽ�ⳣ���Ķ����K(CH3COOH)��![]() ��
��![]() ��1.8��10��5��c(CH3COOH)��0.5 mol��L��1����c(H��)��3��10��3mol��L��1����ˮ�������������Ũ��ԼΪ
��1.8��10��5��c(CH3COOH)��0.5 mol��L��1����c(H��)��3��10��3mol��L��1����ˮ�������������Ũ��ԼΪ![]() mol��L��1�����ɴ���������c(H��)Լ����ˮ�������c(H��)��
mol��L��1�����ɴ���������c(H��)Լ����ˮ�������c(H��)��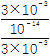 ��9��108����
��9��108����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���CO��CO2��ɵĻ������13.44 L��������Ϊ24g���˻��������CO�� CO2�����ʵ���֮���ǣ� ��
A��3��7 B��3��4 C��4��7 D��1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӻ�������������ȡ�����ƵĹ������£�
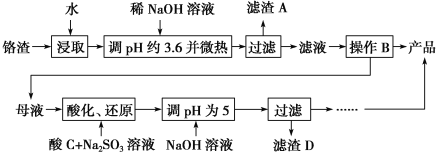
��֪������������Na2SO4������Cr2O![]() ��Fe3����
��Fe3����
��Fe3����Cr3����ȫ����(c��1.0��10��5mol��L��1)ʱpH�ֱ�Ϊ3.6��5��
(1)���ȡ����ܼӿ췴Ӧ�����⣬ͬʱ������________________________������AΪ________(�ѧʽ)��
(2)�����ܽ��(S)���¶�(T)���ߣ�����B����ѷ���Ϊ________(����ĸ���)��
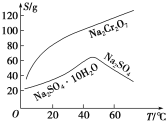
A������Ũ�������ȹ���
B������Ũ�������½ᾧ������
(3)�ữ��Cr2O![]() �ɱ�SO
�ɱ�SO![]() ��ԭ��Cr3�������ӷ���ʽΪ_____________________��
��ԭ��Cr3�������ӷ���ʽΪ_____________________��
��CΪ______________��Cr(OH)3���ܶȻ�����Ksp[Cr(OH)3]��____________��
(4)����2CrO![]() ��2H��
��2H��![]() Cr2O
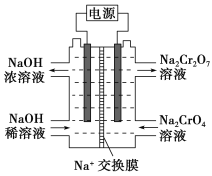
Cr2O![]() ��H2O���ͼʾװ��(��Ϊ���Ե缫)���Na2CrO4��Һ��ȡNa2Cr2O7��ͼ���Ҳ�缫���ӵ�Դ��________������缫��ӦʽΪ____________________________��
��H2O���ͼʾװ��(��Ϊ���Ե缫)���Na2CrO4��Һ��ȡNa2Cr2O7��ͼ���Ҳ�缫���ӵ�Դ��________������缫��ӦʽΪ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪̼���ʵ�ȼ����Ϊ��393.5 kJmol-1��CO��ȼ����Ϊ��283kJmol-1��д��̼����ȫȼ������CO���Ȼ�ѧ����ʽ______________________________________��
��2����COΪȼ�ϣ������Ƴ�ȼ�ϵ�ء���COΪȼ�ϣ�����̼����Ϊ����ʵ�ȼ�ϵ������ͨ���������_____________�������ĵ缫��Ӧʽ____________________________��
��3��CO������β��֮һ��������Ⱦ�������������ϰ�װβ����������������Ӧ��
2NO��g��+2CO��g��![]() N2��g��+2CO2��g����
N2��g��+2CO2��g����
���ڹ̶��ݻ�Ϊ2L���ܱ�������ͨ��NO��CO��2mol����������Ӧ�����¶ȣ�T����ѹǿ��P����ʱ�䣨t���ı仯������ͼ��ʾ����ش��������⣺
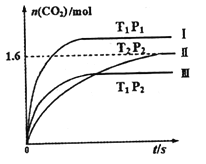
������I��II��III��Ӧ��Ӧ�ӿ�ʼ��ƽ��ʱ��CO2��ʾ��ƽ����Ӧ���ʷֱ�ΪV(I)��V(II)��V(III)�������ߴ�С��ϵΪ______________��
�ڸ÷�Ӧ��H__________0(�����������������)������II��Ӧƽ�ⳣ��K=_________��
����II��Ӧ�ķ�Ӧ��ƽ�����ͨ��2molNO��2molCO�������¶Ȳ��䣬���ٴ�ƽ��ʱNO��ת���ʽ�_______�����������С�����䡱����
����ά���¶�ΪT2ѹǿΪP2�������£����������ַ����ı���ʼ���ʵ��������ﵽƽ���CO2��Ũ��Ϊ0.8 mol��L��1����______________________________��
A��4mol NO��4 mol CO B��2 mol N2+2 mol CO2
C��1mol NO��1mol CO��1 mol N2+2 mol CO2 D��1mol NO��2mol N2��2 mol CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����������Ҵ���˵����ȷ����(����)
A. ��Ϊͬ���칹�� B. ��������Ϊ��ȩ
C. ˮ��Һ�������� D. ����ʯ����Һ���м���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.HClO�����ᣬ����NaClO���������
B.CCl4�����ڼ�����ˮ�͵�ˮ
C.Ư���ڿ����в��ȶ�����˿�����Ư��ֽ��
D.���Ҵ���ȡ�ķ������Է�������ˮ�ĵ⣬����Ϊ�����Ҵ��е��ܽ�Ƚϴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���̬ԭ�ӻ����ӵĵ����Ų�ʽ������ǣ� ��
A. Al 1s22s22p63s23p1 B. S2- 1s22s22p63s23p6
C. Cu��[Ar]3d94s2 D. Ca��[Ar] 4s2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ��������˵����ȷ���ǣ� ��
A.ȼúʱ��������ʯ��ʯ���ɼ��ٷ�����SO2����
B.�����������������10��4%�Ŀ������������彡��
C.CO��NO��NO2���Ǵ�����Ⱦ���壬�ڿ����ж����ȶ�����
D.���ϳ�ϴ�Ӽ����ڱ�ϸ���ֽ⣬�ʲ��ᵼ��ˮ����Ⱦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ��Ӧ�ȵ�˵������ȷ����
A���ı�����������ܸı仯ѧ��Ӧ����
B����ij��Ӧ��һ�������´ﵽ��Ӧ��ʱ���ﵽ�˻�ѧƽ��״̬
C����ij��Ӧ��ϵ�������ѹǿ���ٸı�ʱ���÷�Ӧһ���ﵽ�˷�Ӧ��
D����ij��Ӧ�ﵽ��ʱ����Ӧ����������Ũ��һ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com