
【题目】(1)已知碳单质的燃烧热为-393.5 kJmol-1,CO的燃烧热为-283kJmol-1,写出碳不完全燃烧生成CO的热化学方程式______________________________________。
(2)以CO为燃料,可以制成燃料电池。以CO为燃料,熔融碳酸盐为电解质的燃料电池正极通入的气体是_____________,负极的电极反应式____________________________。
(3)CO是汽车尾气之一,严重污染空气,在汽车上安装尾气处理器,发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
现在固定容积为2L的密闭容器中通入NO和CO各2mol发生上述反应,随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
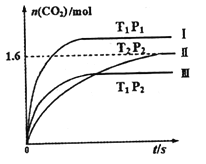
①曲线I、II、III对应反应从开始到平衡时用CO2表示的平均反应速率分别为V(I)、V(II)、V(III),则三者大小关系为______________。
②该反应△H__________0(填“>”、“=”或“<”);曲线II对应平衡常数K=_________;
曲线II对应的反应达平衡后,再通入2molNO和2molCO并保持温度不变,则再达平衡时NO的转化率将_______(填“增大”、“减小”或“不变”)。
③若维持温度为T2压强为P2的条件下,按下列四种方法改变起始物质的用量,达到平衡后,CO2的浓度为0.8 mol·L-1的是______________________________。
A.4mol NO+4 mol CO B.2 mol N2+2 mol CO2
C.1mol NO+1mol CO+1 mol N2+2 mol CO2 D.1mol NO+2mol N2+2 mol CO2
【答案】 2C(s)+ O2(g)= 2CO(g)△H=-221kJmol-1 O2 、CO2 CO-2e- + CO32- = 2CO2 V(I) >V(III) >V(II) < 160 增大 AC
【解析】试题分析:(1)根据碳单质的燃烧热写碳完全燃烧的热化学方程式,根据CO的燃烧热写CO燃烧的热化学方程式,根据盖斯定律写碳不完全燃烧生成CO的热化学方程式。
(2)以CO为燃料,熔融碳酸盐为电解质的燃料电池正极反应是![]() ,负极是CO失电子生成CO2。
,负极是CO失电子生成CO2。
(3)CO是汽车尾气之一,严重污染空气,在汽车上安装尾气处理器,发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
现在固定容积为2L的密闭容器中通入NO和CO各2mol发生上述反应,随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
①根据曲线的拐点时间来确定化学反应速率的大小。
②根据温度对化学平衡的影响知识来回答△H;根据三段式来进行计算曲线II对应平衡常数;据化学平衡移动的影响因素来确定转化率的变化;。
③根据等效平衡原理分析。
解析:(1)碳完全燃烧的热化学方程式①![]() H=-393.5 kJmol-1, CO燃烧的热化学方程式②
H=-393.5 kJmol-1, CO燃烧的热化学方程式②![]() -283kJmol-1 ,根据盖斯定律,①×2-②×2得碳不完全燃烧生成CO的热化学方程式2C(s)+ O2(g)= 2CO(g)△H=-221kJmol-1。
-283kJmol-1 ,根据盖斯定律,①×2-②×2得碳不完全燃烧生成CO的热化学方程式2C(s)+ O2(g)= 2CO(g)△H=-221kJmol-1。
(2)以CO为燃料,熔融碳酸盐为电解质的燃料电池正极反应是![]() ,所以正极通入O2 、CO2;负极是CO失电子生成CO2,电极反应为CO-2e- + CO32- = 2CO2。
,所以正极通入O2 、CO2;负极是CO失电子生成CO2,电极反应为CO-2e- + CO32- = 2CO2。
(3)①根据“先拐先平”速率快,CO2表示的平均反应速率V(I) >V(III) >V(II)。
②根据曲线II、III,可知![]() ,升高温度CO2的含量降低,△H<0;
,升高温度CO2的含量降低,△H<0;

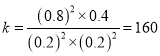
曲线II对应的反应达平衡后,再通入2molNO和2molCO并保持温度不变,相当于加压,再达平衡时NO的转化率将增大;
③维持温度为T2压强为P2的条件下,根据等效平衡原理,为等比等效,故AC正确。


科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定增大
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定增大
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A. ①④ B. ①②③
C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:
N2O4(g)![]() 2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2
②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧ C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成语是中华民族灿烂文化中的瑰宝,许多成语中蕴含着丰富的化学原理,下列成语中涉及氧化还原反应的是
A. 木已成舟 B. 铁杵成针 C. 蜡炬成灰 D. 滴水成冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 8 g O2含有 4NA个电子
B. 1 L 1 mol·L-1的H2SO4溶液所含氧原子数为 4NA
C. 标准状况下,22.4 L O2和CO2的混合气体所含原子数为 2.5 NA
D. 标准状况下,22.4 L CCl4含有NA个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=________。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的主要离子方程式为_______________________________________,由水电离出的
c(OH-)=________mol·L-1。
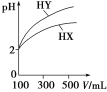
(3)体积均为100 mL、pH均为2的一元酸HX、HY,加水稀释过程中pH与溶液体积的关系如图所示,则HX是________(填“强酸”或“弱酸”),理由是_________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为______________________(填化学式)。
②25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见物质的俗名与化学式对应正确的是
A. 熟石灰—— Ca(OH)2B. 铁红—— Fe3O4
C. 光导纤维—— SiD. 酒精—— CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com