
����Ŀ��100��ʱ����0.1 mol N2O4����1L�ܱյ���ƿ�У�Ȼ����ƿ����100�� �ĺ��²��У���ƿ�ڵ�������Ϊ����ɫ��
N2O4(g)![]() 2NO2(g)�����н��۲���˵��������Ӧ�ڸ��������Ѿ��ﵽƽ��״̬����
2NO2(g)�����н��۲���˵��������Ӧ�ڸ��������Ѿ��ﵽƽ��״̬����
��N2O4������������NO2����������֮��Ϊ1:2
��NO2����������NO2�����������
����ƿ�������ѹǿ���ٱ仯
����ƿ��������������ٱ仯
��NO2�����ʵ���Ũ�Ȳ��ٸı�
����ƿ���������ɫ���ټ���
����ƿ�������ƽ����Է����������ٱ仯
����ƿ��������ܶȲ��ٱ仯��
A. �ڢۢޢ� B. �٢ܢ� C. ֻ���٢� D. ֻ���ߢ�
���𰸡�B
������������������ж�һ����Ӧ�Ƿ�ﵽƽ��״̬��ʵ�������淴Ӧ������ȣ���־�����������Ƿ���������ﵽ��������������N2O4������������NO2���������ʣ�����ʾ����Ӧ������NO2�������ʣ���ʾ�淴Ӧ��NO2�������ʣ���ʾ����Ӧ�������������ʼ�ղ��䣻����ƿ�������ƽ����Է����������ù�ʽM=m/n���㣬m���䣬nǰ��ͬ����M�DZ仯�ģ�����ﵽ���䣬��Ӧ��ﵽƽ�⣻����ƿ��������ܶ���=m/V,m���䣬����Ϊ1L�ܱյ���ƿ�����ܶ���ʼ����û�б仯��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�鹹�뽫����β��(NO��NO2)ת��Ϊ��Ҫ�Ļ���ԭ��HNO3����ԭ����ͼ��ʾ������A��BΪ��ײ��ϡ�����˵����ȷ����( )
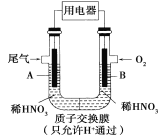
A���������Һ�е����ķ�����B��A�����ӵ�������֮�෴
B���缫A���淴Ӧ֮һΪNO��3e����2H2O===NO![]() ��4H��
��4H��
C���缫B������c(NO![]() )����
)����
D���õ�ع���ʱ��ÿת��4 mol���ӣ�����22.4 L O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���CO��CO2��ɵĻ������13.44 L��������Ϊ24g���˻��������CO�� CO2�����ʵ���֮���ǣ� ��
A��3��7 B��3��4 C��4��7 D��1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������MnO2��KClO3�ֽ���ȡ����Ҫ�����ᴿ�������е�MnO2����ȷ�IJ���������
A.�ܽ⡢���ˡ����� B. �ܽ⡢���ˡ��ᾧ
C. �ܽ⡢���ˡ�ϴ�ӡ����� D.�ܽ⡢�ᾧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ�����Ʊ������մɵ�ԭ��MgO��MgSO4��s��+CO��g��MgO��s��+CO2��g��+SO2��g����H��0�÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������y��x�仯���ƺ������ǣ� ��
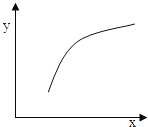
A. x��ʾ�¶ȣ�y��ʾ�����ڻ��������ܶ�
B. x��ʾCO�����ʵ�����y��ʾCO2��CO�����ʵ���֮��
C. x��ʾSO2��Ũ�ȣ�y��ʾƽ�ⳣ��K
D. x��ʾMgSO4�������������������y��ʾCO��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��ŵ������ѧ���ɷ�������������������λ��ѧ�ҷֻ��Ա��������ڷ��ӻ��������ϳ�������ijɾͣ�����һ�ֹ�����������ṹ����ͼ��ʾ���йظ÷��ӵ�˵������ȷ����

A. ������������ķ���ʽ��C34H46O2���������ĺ���������
B. ���ӻ��������ϳɵ��о��ɹ�Ϊδ���²��ϵ��з������˹���ǰ��
C. ��λ��ѧ��ͨ���о����Ӻ��������ºϳ����µ�Ԫ��
D. ����������������NaHCO3������KMnO4��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
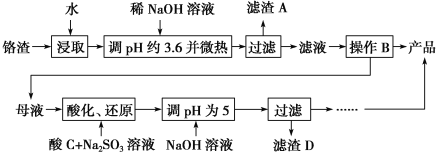
����Ŀ���ӻ�������������ȡ�����ƵĹ������£�
��֪������������Na2SO4������Cr2O![]() ��Fe3����
��Fe3����
��Fe3����Cr3����ȫ����(c��1.0��10��5mol��L��1)ʱpH�ֱ�Ϊ3.6��5��
(1)���ȡ����ܼӿ췴Ӧ�����⣬ͬʱ������________________________������AΪ________(�ѧʽ)��
(2)�����ܽ��(S)���¶�(T)���ߣ�����B����ѷ���Ϊ________(����ĸ���)��
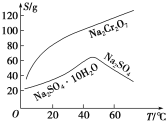
A������Ũ�������ȹ���
B������Ũ�������½ᾧ������
(3)�ữ��Cr2O![]() �ɱ�SO
�ɱ�SO![]() ��ԭ��Cr3�������ӷ���ʽΪ_____________________��
��ԭ��Cr3�������ӷ���ʽΪ_____________________��
��CΪ______________��Cr(OH)3���ܶȻ�����Ksp[Cr(OH)3]��____________��
(4)����2CrO![]() ��2H��
��2H��![]() Cr2O
Cr2O![]() ��H2O���ͼʾװ��(��Ϊ���Ե缫)���Na2CrO4��Һ��ȡNa2Cr2O7��ͼ���Ҳ�缫���ӵ�Դ��________������缫��ӦʽΪ____________________________��
��H2O���ͼʾװ��(��Ϊ���Ե缫)���Na2CrO4��Һ��ȡNa2Cr2O7��ͼ���Ҳ�缫���ӵ�Դ��________������缫��ӦʽΪ____________________________��
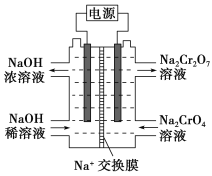
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪̼���ʵ�ȼ����Ϊ��393.5 kJmol-1��CO��ȼ����Ϊ��283kJmol-1��д��̼����ȫȼ������CO���Ȼ�ѧ����ʽ______________________________________��
��2����COΪȼ�ϣ������Ƴ�ȼ�ϵ�ء���COΪȼ�ϣ�����̼����Ϊ����ʵ�ȼ�ϵ������ͨ���������_____________�������ĵ缫��Ӧʽ____________________________��
��3��CO������β��֮һ��������Ⱦ�������������ϰ�װβ����������������Ӧ��
2NO��g��+2CO��g��![]() N2��g��+2CO2��g����
N2��g��+2CO2��g����
���ڹ̶��ݻ�Ϊ2L���ܱ�������ͨ��NO��CO��2mol����������Ӧ�����¶ȣ�T����ѹǿ��P����ʱ�䣨t���ı仯������ͼ��ʾ����ش��������⣺
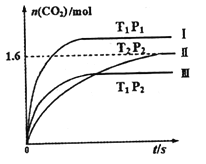
������I��II��III��Ӧ��Ӧ�ӿ�ʼ��ƽ��ʱ��CO2��ʾ��ƽ����Ӧ���ʷֱ�ΪV(I)��V(II)��V(III)�������ߴ�С��ϵΪ______________��
�ڸ÷�Ӧ��H__________0(�����������������)������II��Ӧƽ�ⳣ��K=_________��
����II��Ӧ�ķ�Ӧ��ƽ�����ͨ��2molNO��2molCO�������¶Ȳ��䣬���ٴ�ƽ��ʱNO��ת���ʽ�_______�����������С�����䡱����
����ά���¶�ΪT2ѹǿΪP2�������£����������ַ����ı���ʼ���ʵ��������ﵽƽ���CO2��Ũ��Ϊ0.8 mol��L��1����______________________________��
A��4mol NO��4 mol CO B��2 mol N2+2 mol CO2
C��1mol NO��1mol CO��1 mol N2+2 mol CO2 D��1mol NO��2mol N2��2 mol CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ��������˵����ȷ���ǣ� ��
A.ȼúʱ��������ʯ��ʯ���ɼ��ٷ�����SO2����
B.�����������������10��4%�Ŀ������������彡��
C.CO��NO��NO2���Ǵ�����Ⱦ���壬�ڿ����ж����ȶ�����
D.���ϳ�ϴ�Ӽ����ڱ�ϸ���ֽ⣬�ʲ��ᵼ��ˮ����Ⱦ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com