
【题目】对于可逆反应2AB3(g)![]() A2(g)+3B2(g) △H>0下列图像不正确的是( )
A2(g)+3B2(g) △H>0下列图像不正确的是( )
A.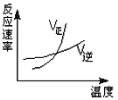 B.
B.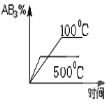
C. D.
D.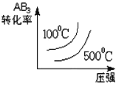
【答案】D
【解析】
可逆反应2AB3(g)A2(g)+3B2(g)△H>0,升高温度,反应速率加快,缩短到达平衡的时间,平衡向正反应方向移动,正反应速率增大的更多,反应物的含量减少;正反应为体积增大的反应,增大压强,平衡逆向移动,反应物的含量增大,以此来解答。
A. 2AB3(g)![]() A2(g)+3B2(g) △H>0升高温度,反应速率加快;因为正反应吸热,升高温度,平衡正向移动,故不选A;
A2(g)+3B2(g) △H>0升高温度,反应速率加快;因为正反应吸热,升高温度,平衡正向移动,故不选A;
B.温度越高,化学反应速率越快,到达平衡所需时间越短;由于正反应吸热,温度升高,有利于反应正向进行,剩余反应物百分含量减少,故不选B;
C.升高温度,平衡正向进行,平衡后AB3的百分含量越低;正反应为体积增大的反应,增大压强,平衡逆向移动,反应物的含量增大,故不选C;
D.正反应为体积增大的反应,增大压强,平衡逆向移动,反应物的转化率应该减小;正反应为吸热反应,当压强相同时,温度越高,越有利于反应正向移动,反应物转化率越高,故选D;
答案:D


科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。

(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。

a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。


铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用废铜屑(含铜、铝等)制备CuSO4·5H2O晶体,制备流程如图:
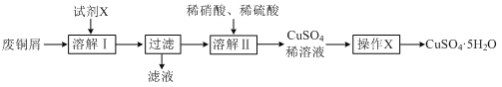
(1)“溶解Ⅰ”过程中所用试剂X为___。(填写试剂名称)
(2)“溶解Ⅱ”发生反应的离子方程式为___。
(3)“操作X”包括___、过滤、无水乙醇洗涤、低温干燥。
(4)某种杀菌剂中含CuSO4和Cu(OH)2,为测定其组成,兴趣小组设计如下实验:取一定量的杀菌剂,将其溶于足量的稀盐酸中,然后向其中加入足量的BaCl2溶液,过滤干燥后得白色固体2.33g。然后向滤液中滴加1.00mol·L-1的Na2H2Y(EDTA)溶液,反应至终点时消耗Na2H2Y溶液30.00 mL(离子方程式为Cu2++H2Y2-=CuY2-+2H+)。
①由准确称量后的EDTA固体配制100mL1.00mol·L-1的EDTA溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②通过计算确定杀菌剂中CuSO4和Cu(OH)2的物质的量之比___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为防治雾霾,设计如下流程吸收工业尾气SO2和NO,同时获得连二亚硫酸钠(Na2S2O4,其结晶水合物又称保险粉)和NH4NO3产品,以变“废”为宝。
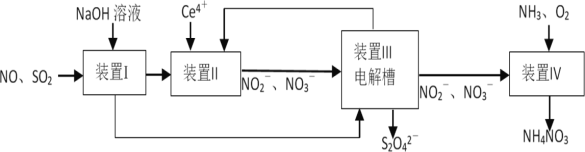
下列说法错误的是
A.S2O![]() 中既存在非极性键又存在极性键
中既存在非极性键又存在极性键
B.装置I的作用是吸收SO2,装置II的作用是吸收NO
C.保险粉可通过装置Ⅲ中阳极产物制备,Ce4+从阴极口流出回到装置II循环使用
D.氧化装置IV中1L 2molL-1NO![]() ,至少需要标准状况下22.4LO2
,至少需要标准状况下22.4LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向1L0.01 molL-1H2B溶液中滴加盐酸或NaOH溶液,溶液中 c(H2B)、c(HB-)、c(B2-)、c(OH-)、c(H+) 的对数值(lgc)与pH的关系如图所示(温度保持不变),下列说法错误的是
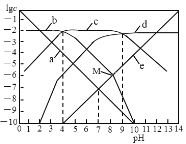
A.曲线c表示lgc(HB-)与pH的关系
B.随pH增加,c(H2B)c(OH-)增大
C.0.01 molL-1Na2B溶液,Kh1(B2-)的数量级为10-9
D.M点溶液中n(Na+)+n(H+)―n(B2-)=0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关(科学探究)为基础,设计了如图实验装置并记录相关实验数据。
(实验装置)
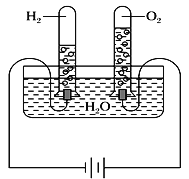
(部分实验数据)
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)在该实验条件下,3 mol O2的气体的体积为____________L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利巴韦林是一种成熟的广谱抗病毒药物,临床上证明它对新型冠状病毒有明显抑制作用。其一条合成路线如下:
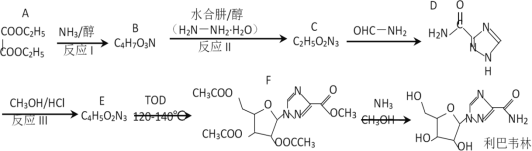
已知:①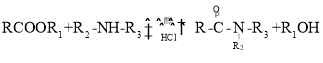 (R代表H或其他基团)
(R代表H或其他基团)
②![]()
回答下列问题:
(1)A的名称为_______________,F中的含氧官能团名称为___________________。
(2)反应I因为反应物用量控制不当,可能会产生副产物,其结构简式为_________,反应I的溶剂使用乙醇而不用甲醇,理由是_______________________________________。
(3)反应II的反应类型为______________。
(4)反应III的反应方程式为_____________________________________________。
(5)G是A的同分异构体,1molG与足量NaHCO3反应生成标准状况下44.8LCO2,符合该条件的G共有_______种。
(6)设计以甘油、乙醇和![]() 为原料制备
为原料制备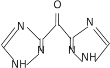 的合成路线_____________(无机试剂任选)。
的合成路线_____________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。如图是在实验室中制备KMnO4晶体的流程:
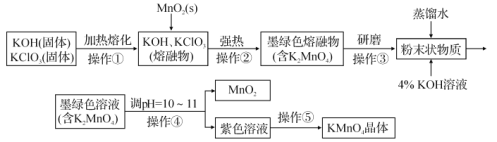
回答下列问题:
(1)在实验流程中,操作①和②均需在坩埚中进行,根据实验实际应选择___(填序号)。
a.铁坩埚 b.石英坩埚 c.瓷坩埚 d.氧化铝坩埚
(2)“熔融物”中KClO3应过量的原因除了提高MnO2利用率外,还有_______。
(3)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为___。若溶液碱性过强,则![]() 又会转化为
又会转化为![]() ,同时产生无色气体,该转化过程中发生反应的离子方程式为___。
,同时产生无色气体,该转化过程中发生反应的离子方程式为___。
(4)还可采用电解K2MnO4溶液(绿色)的方法制备KMnO4(装置如图所示)。
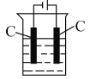
①电解过程中右侧石墨电极的电极反应式为________。
②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是________。
③为避免该现象,请提出改进装置的措施:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断正确的是( )
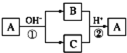
A.X元素可能为AlB.反应①和②互为可逆反应
C.X元素可能为SiD.反应①和②一定为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com