
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。如图是在实验室中制备KMnO4晶体的流程:
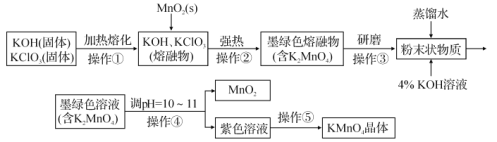
回答下列问题:
(1)在实验流程中,操作①和②均需在坩埚中进行,根据实验实际应选择___(填序号)。
a.铁坩埚 b.石英坩埚 c.瓷坩埚 d.氧化铝坩埚
(2)“熔融物”中KClO3应过量的原因除了提高MnO2利用率外,还有_______。
(3)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为___。若溶液碱性过强,则![]() 又会转化为
又会转化为![]() ,同时产生无色气体,该转化过程中发生反应的离子方程式为___。
,同时产生无色气体,该转化过程中发生反应的离子方程式为___。
(4)还可采用电解K2MnO4溶液(绿色)的方法制备KMnO4(装置如图所示)。
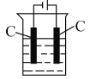
①电解过程中右侧石墨电极的电极反应式为________。
②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是________。
③为避免该现象,请提出改进装置的措施:________。
【答案】a KClO3会分解 3![]() +2H2O=2
+2H2O=2![]() +MnO2↓+4OH- 4
+MnO2↓+4OH- 4![]() +4OH-=4
+4OH-=4![]() +O2↑+2H2O
+O2↑+2H2O ![]() -e-=
-e-=![]() 电解较长时间后,阳极产生的
电解较长时间后,阳极产生的![]() 在阴极被还原,溶液颜色由紫色转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,
在阴极被还原,溶液颜色由紫色转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,![]() 转化为
转化为![]() ,溶液颜色由紫色转变为绿色) 在两电极之间增加阳离子交换膜,阴极室用氢氧化钾溶液,阳极室用锰酸钾溶液
,溶液颜色由紫色转变为绿色) 在两电极之间增加阳离子交换膜,阴极室用氢氧化钾溶液,阳极室用锰酸钾溶液
【解析】
KOH与KClO3固体混合物在铁坩埚中加热至熔化,然后向其中加入MnO2,发生氧化还原反应产生K2MnO4、KCl,将所得固体冷却后研磨,得到固体粉末,然后加入蒸馏水,并加入4%KOH溶液,调整溶液pH至10~11,K2MnO4发生歧化反应产生MnO2、KMnO4,然后过滤除去MnO2固体,得到的溶液中含KMnO4,然后将溶液蒸发浓缩、冷却结晶得到KMnO4晶体。
(1)在实验流程中,操作①和②均需在坩埚中进行,由于物质中含有强碱KOH,KOH能够与石英坩埚、瓷坩埚中的SiO2反应,也能够与氧化铝坩埚中的Al2O3发生反应,因此应该选用铁坩埚,故合理选项是a;
(2)“熔融物”中KClO3应过量,原因除了可以提高MnO2利用率外,还有就是KClO3不稳定,受热分解产生KCl和O2;
(3)K2MnO4在碱性条件下发生歧化反应,产生MnO2、KMnO4,根据得失电子守恒、电荷守恒、原子守恒,该反应的离子方程式为:3![]() +2H2O=2
+2H2O=2![]() +MnO2↓+4OH-;但若溶液液碱性过强,由于
+MnO2↓+4OH-;但若溶液液碱性过强,由于![]() 具有强的氧化性,会将溶液中的OH-氧化产生O2,
具有强的氧化性,会将溶液中的OH-氧化产生O2,![]() 被还原产生
被还原产生![]() ,该转化过程中发生反应的离子方程式为:4
,该转化过程中发生反应的离子方程式为:4![]() +4OH-=4
+4OH-=4![]() +O2↑+2H2O;
+O2↑+2H2O;
(4)①用石墨电极电解K2MnO4溶液,右侧电解连接电源正极,为阳极,在阳极上溶液中的![]() 失去电子发生氧化反应变为
失去电子发生氧化反应变为![]() ,使溶液逐渐变为紫色,电极反应式为:
,使溶液逐渐变为紫色,电极反应式为:![]() -e-=
-e-=![]() ;
;
②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是在阴极上溶液中的H+不断放电产生H2逸出,使溶液碱性增强,![]() 转化为
转化为![]() ,溶液颜色又由紫色逐渐转化为绿色;
,溶液颜色又由紫色逐渐转化为绿色;
③为避免该现象发生,改进装置的措施是:在两电极之间增加阳离子交换膜,阴极室用氢氧化钾溶液,阳极室用锰酸钾溶液,这样就可以避免碱性环境中![]() 转化为
转化为![]() 。
。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】在燃烧2.24L(标准状况)CO与O2的混合气体时,放出11.32kJ的热量,最后产物的密度为原来气体密度的1.25倍,则CO的燃烧热为
A. 283 kJ·mol-1 B. -283 kJ·mol-1 C. -566 kJ·mol-1 D. 566kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有强还原性。下列说法正确的是( )
A.NaH2PO2属于酸式盐,其水溶液呈碱性
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2 + 3OH- =![]() + 3H2O
+ 3H2O
C.向NaH2PO2溶液中滴加浓硝酸反应的离子方程式为:![]() + H+=H3PO2
+ H+=H3PO2
D.利用 (H3PO2)进行化学镀银反应中,1molH3PO2 最多还原 4 mol Ag+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水的质量关系到关系到每个人的健康,因含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能,为了降低饮用水中NO3-的浓度,某兴趣小组提出如图方案:
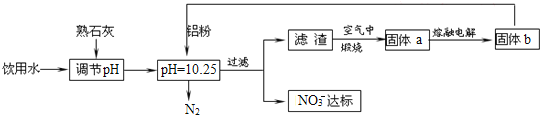
请回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(胃酸的主要成分是HCl)作用下转化成亚铁盐。写出该反应的离子方程式:____。
(2)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为__。
(3)该方案中选用熟石灰调节pH,理由是___、___。
(4)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为___。
(5)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图,试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____。
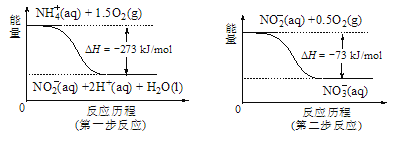
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的O2和O3的质量比______,分子个数比为_______,所含氧原子的个数比为_______。
(2)在200 mL 2 mol·L-1MgCl2溶液中,溶质的质量为_______。Cl-的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。一定条件下,如图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其他有机物生成)。电流效率=(生成目标产物消耗的电子数/转移的电子总数)×100%,则下列说法错误的是( )
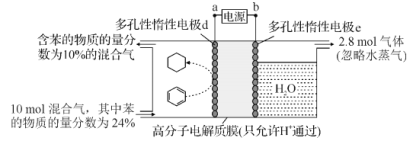
A.电子移动方向为:a→d;e→b
B.d电极反应式为C6H6+6H++6e-=C6H12
C.该储氢装置的电流效率明显小于100%,其原因可能是除目标产物外,还有H2生成
D.由图中数据可知,此装置的电流效率约为32.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com