
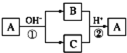
����Ŀ������ʹ�����Ϊ�������õĹؼ��������ǵ�ǰ��ѧ����Ҫ��ע���ȵ����⡣һ�������£���ͼ��ʾװ�ÿ�ʵ���л���ĵ绯ѧ����(��Ŀ������⣬������Ϊ�������л�������)������Ч��=(����Ŀ��������ĵĵ�����/ת�Ƶĵ�������)��100%��������˵��������ǣ� ��
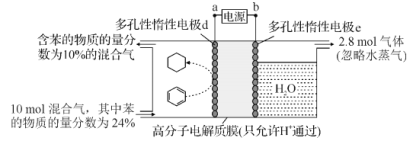
A.�����ƶ�����Ϊ��a��d��e��b
B.d�缫��ӦʽΪC6H6+6H++6e-=C6H12
C.�ô���װ�õĵ���Ч������С��100%����ԭ������dz�Ŀ������⣬����H2����
D.��ͼ�����ݿ�֪����װ�õĵ���Ч��ԼΪ32.1%
���𰸡�D
��������
��ͼ��֪����װ��Ϊ���أ����ڵ缫dת��Ϊ�����飬�ù����Ǽ�����̣����ڻ�ԭ��Ӧ����缫dΪ���ص��������缫eΪ���ص�����������aΪ��Դ�ĸ�����bΪ��Դ���������ݴ˷������
A�����ݷ�����dΪ���ص��������缫eΪ���ص�����������aΪ��Դ�ĸ�����bΪ��Դ����������Դ�ڲ������ƶ�����Ϊ��a��d�������е��ӵ��ƶ�����Ϊe��b����A��ȷ��
B��dΪ���ص�������������ԭ��Ӧ��d�缫�ϱ�ת��Ϊ�����飬���ڵõ���Ĺ��̣�������ԭ��Ӧ�����ڴ������ӽ���Ĥ�������������������ƶ�����d�缫��ӦʽΪC6H6+6H++6e-=C6H12����B��ȷ��
C����������Ŀ������⣬�����ܷ��������ӵõ������������ĵ缫��Ӧ������������Ϊ��������C��ȷ��
D����������2.8mol�����壬������Ӧ��Ϊ������OH-�ŵ����ɵ�����������һ��������ʧȥ4�����ӣ���ת�Ƶ��ӵ����ʵ���Ϊ2.8mol��4=11.2mol����������ͨ�����������ĵ�����Ŀ��ȣ��������õ�����ҲΪ11.2mol�������缫��ӦΪ�� C6H6+6H++6e-=C6H12�����뷴Ӧ�ı������ʵ���Ϊ10mol��24%-12mol��10%=1.2mol�������ɻ��������ĵĵ�����Ϊ7.2mol���������������ĵ缫��ӦΪ��2H++2e-=H2���������������ĵĵ�����Ϊ11.2mol-7.2mol=4mol�����װ�õĵ���Ч��Ϊ![]() ��100%��64.3%����D����
��100%��64.3%����D����
��ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�����÷�ͭм����ͭ�����ȣ��Ʊ�CuSO4��5H2O���壬�Ʊ�������ͼ��
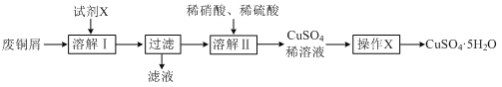
��1�����ܽ���������������Լ�XΪ___������д�Լ����ƣ�
��2�����ܽ����������Ӧ�����ӷ���ʽΪ___��
��3��������X������___�����ˡ���ˮ�Ҵ�ϴ�ӡ����¸��
��4��ij��ɱ�����к�CuSO4��Cu(OH)2��Ϊ�ⶨ����ɣ���ȤС���������ʵ�飺ȡһ������ɱ��������������������ϡ�����У�Ȼ�������м���������BaCl2��Һ�����˸����ð�ɫ����2.33g��Ȼ������Һ�еμ�1.00mol��L-1��Na2H2Y(EDTA)��Һ����Ӧ���յ�ʱ����Na2H2Y��Һ30.00 mL(���ӷ���ʽΪCu2+��H2Y2-=CuY2-��2H+)��
����ȷ�������EDTA��������100mL1.00mol��L-1��EDTA��Һ����IJ����������ձ�����ͷ�ι����___��
��ͨ������ȷ��ɱ������CuSO4��Cu(OH)2�����ʵ���֮��___��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Τ����һ�ֳ���Ĺ�������ҩ��ٴ���֤����������״�����������������á���һ���ϳ�·�����£�
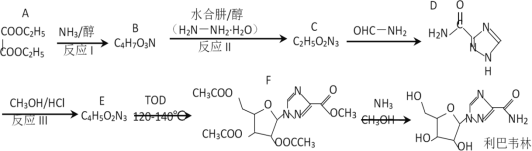
��֪����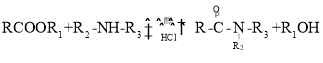 (R����H����������)
(R����H����������)
��![]()
�ش��������⣺
(1)A������Ϊ_______________��F�еĺ�������������Ϊ___________________��
(2)��ӦI��Ϊ��Ӧ���������Ʋ��������ܻ�����������ṹ��ʽΪ_________����ӦI���ܼ�ʹ���Ҵ������ü״�,������_______________________________________��
(3)��ӦII�ķ�Ӧ����Ϊ______________��
(4)��ӦIII�ķ�Ӧ����ʽΪ_____________________________________________��
(5)G��A��ͬ���칹�壬1molG������NaHCO3��Ӧ���ɱ�״����44.8LCO2�����ϸ�������G����_______�֡�
(6)����Ը��͡��Ҵ���![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�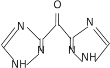 �ĺϳ�·��_____________(���Լ���ѡ)��
�ĺϳ�·��_____________(���Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
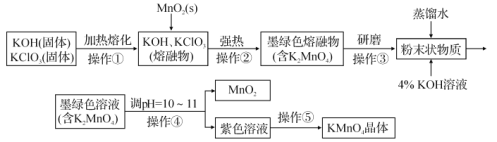
����Ŀ������������̵���Ҫ������ͳ��õ�����������ͼ����ʵ�������Ʊ�KMnO4��������̣�
�ش��������⣺
(1)��ʵ�������У������ٺ͢ھ����������н��У�����ʵ��ʵ��Ӧѡ��___(�����)��
a�������� b��ʯӢ���� c�������� d������������
(2)������������KClO3Ӧ������ԭ��������MnO2�������⣬����_______��
(3)��������ʹK2MnO4ת��ΪKMnO4��MnO2����ת�������з�����Ӧ�����ӷ���ʽΪ___������Һ���Թ�ǿ����![]() �ֻ�ת��Ϊ
�ֻ�ת��Ϊ![]() ��ͬʱ������ɫ���壬��ת�������з�����Ӧ�����ӷ���ʽΪ___��
��ͬʱ������ɫ���壬��ת�������з�����Ӧ�����ӷ���ʽΪ___��
(4)���ɲ��õ��K2MnO4��Һ(��ɫ)�ķ����Ʊ�KMnO4(װ����ͼ��ʾ)��
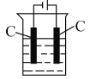
�ٵ��������Ҳ�ʯī�缫�ĵ缫��ӦʽΪ________��
�����ŵ��Ľ��У���Һ������ɫ��Ϊ��ɫ���������ʱ���������Һ��ɫ�ֻ�ת�����ɫ������ԭ����________��
��Ϊ���������������Ľ�װ�õĴ�ʩ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���(Re)��������ɫ���ؽ������ǵ���ؿ�����ϡ�е�Ԫ��֮һ�����㷺Ӧ���ں��պ��������ڹ�ҵ�ϣ��������պ�ReS2�Ŀ�ۣ������Ʊ�Re2O7����һ��;���Ǵ���ͭ�ķ�Һ����ȡ画��������������ͼ(���ָ�����ʡ�ԣ���ڷ�Һ����ReO4-��ʽ����)������˵��������ǣ� ��
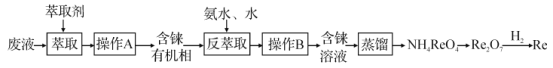
A.��������ȡ���У����백ˮ��ˮ��Ŀ������ȡ�л����е�ReO4-
B.��NH4ReO4�Ʊ�Re2O7�Ĺ����У������ĸ�����ɻ�������
C.ʵ������H2��ԭRe2O7�Ĺ����У�һ������7 mol H2������Ƶ�2 mol Re
D.�Ժ�ReS2�Ŀ�ʯԭ������48.4 t Re2O7��������ת�Ƶ���3.0��106 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����CH4��g��+2O2��g���TCO2��g��+2H2O��g����H1
��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H2
��CH4��g��+![]() O2��g���TCH3OH��l����H3
O2��g���TCH3OH��l����H3
��H2O��g���TH2O��l����H4
��CH3OH��l��+![]() O2��g���TCO2��g��+2H2O��l����H5
O2��g���TCO2��g��+2H2O��l����H5
���й���������Ӧ�ʱ���жϲ���ȷ���ǣ�������
A.��H1����H2B.��H2=��H1+��H4C.��H3=��H2����H5D.��H4��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�����(CH2=CH��COOCH3)��һ����Ҫ���л��ϳ��м��壬�е�Ϊ80.5�档ijʵ��С����ȡ��ϩ�������װ����ͼ��ʾ��

�ش��������⣺
I.��ϩ��������Ʊ����ᴿ
����1����10.0g��ϩ�ᡢ6.0g�״���2mLŨ���������������ƿ�У����Ӻ������ܣ��ý�������裬ˮԡ���ȡ�
����2����ַ�Ӧ����ȴ������Һ�м���5%Na2CO3��Һϴ�����ԣ�������л��ࡣ
����3���л��ྭ��ˮNa2SO4������ˡ����ñ�ϩ�������
(1)����1װ����ͼ1��ʾ(���Ⱥͼг�װ������ȥ)��������ƿ�н��еĿ��淴Ӧ��ѧ����ʽΪ___����ʵ���������ײ����ĸ�����Ľṹ��ʽΪ___��
(2)����b������Ϊ___��
(3)���Һ��5%Na2CO3��Һϴ�ӵ�Ŀ����___��
(4)ʵ��������100g5%Na2CO3��Һ���õ��IJ���������___��
(5)���ڲ�Ʒ���������(�г�װ��δ����)��ͼ2��ʾ��������3(����)�IJ������룺��װ����װ�ã��������������ʺͷ�ʯ��___����ȥǰ��֣��ռ�80.5�����֡�
II.��ϩ����������IJⶨ
����1������״�����ᴿ��ƽ���ֳ�5�ݣ�ȡ��1��������ƿ�У�����2.5mol��L-1��KOH��Һ10.00mL������ʹ֮��ȫˮ�⡣
����2���÷�̪��ָʾ��������ȴ�����Һ�еμ�0.5mol��L-1��HCl��Һ���к�����KOH���ε��յ�ʱ����������20.00mL��
(6)����������Ӧ��ϩ���ת����Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ�ֳ����ĵ��ʣ�B��CΪ��ѧ�����Ļ����A��B��C������Ԫ��X����������ͼ��ʾ��ת����ϵ(���ֲ��P��Ӧ��������ȥ)�������ж���ȷ����( )
A.XԪ�ؿ���ΪAlB.��Ӧ��������Ϊ���淴Ӧ
C.XԪ�ؿ���ΪSiD.��Ӧ������һ��Ϊ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.������������������������Ӧ��2H++SO42-+Ba2++2OH-=BaSO4��+2H2O
B.��������Һ�������Һ��ϣ�SiO32-+2H+=H2SiO3��
C.����ˮ��Ӧ��Na+2H2O=Na��+2OH-+H2��
D.Ũ�����м���������۲����ȣ�Fe+3NO3-+6H+![]() Fe3++3NO2��+3H2O
Fe3++3NO2��+3H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com