
【题目】利巴韦林是一种成熟的广谱抗病毒药物,临床上证明它对新型冠状病毒有明显抑制作用。其一条合成路线如下:
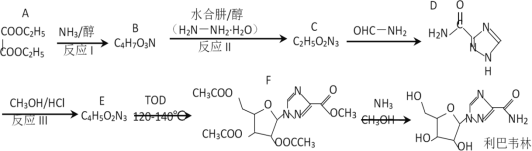
已知:①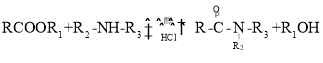 (R代表H或其他基团)
(R代表H或其他基团)
②![]()
回答下列问题:
(1)A的名称为_______________,F中的含氧官能团名称为___________________。
(2)反应I因为反应物用量控制不当,可能会产生副产物,其结构简式为_________,反应I的溶剂使用乙醇而不用甲醇,理由是_______________________________________。
(3)反应II的反应类型为______________。
(4)反应III的反应方程式为_____________________________________________。
(5)G是A的同分异构体,1molG与足量NaHCO3反应生成标准状况下44.8LCO2,符合该条件的G共有_______种。
(6)设计以甘油、乙醇和![]() 为原料制备
为原料制备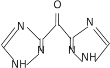 的合成路线_____________(无机试剂任选)。
的合成路线_____________(无机试剂任选)。
【答案】乙二酸二乙酯或草酸二乙酯 醚键、酯基 ![]() 以甲醇为溶剂时因为存在酯交换反应而有杂质草酰胺甲酯
以甲醇为溶剂时因为存在酯交换反应而有杂质草酰胺甲酯![]() 取代反应
取代反应  9
9 
【解析】
有合成路线分析可知,反应Ⅰ为A与NH3的醇溶液发生已知反应①生成B(C4H7O3N)和C2H5OH,则B的结构简式为![]() ,反应Ⅱ为B与水合肼的醇溶液发生已知反应①生成C(C2H5O2N3)和C2H5OH,则C的结构简式为
,反应Ⅱ为B与水合肼的醇溶液发生已知反应①生成C(C2H5O2N3)和C2H5OH,则C的结构简式为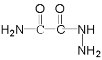 ,C与OHC-NH2反应生成D,D与CH3OH/HCl发生已知反应②生成E(C4H5O2N3),则E的结构简式为
,C与OHC-NH2反应生成D,D与CH3OH/HCl发生已知反应②生成E(C4H5O2N3),则E的结构简式为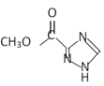 ,E与TOD在120-140℃时反应生成F,F再与NH3的CH3OH溶液发生已知反应①生成利巴韦林,据此分析解答问题。
,E与TOD在120-140℃时反应生成F,F再与NH3的CH3OH溶液发生已知反应①生成利巴韦林,据此分析解答问题。
(1)A的结构简式为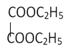 ,名称为乙二酸二乙酯或草酸二乙酯,F的结构简式为
,名称为乙二酸二乙酯或草酸二乙酯,F的结构简式为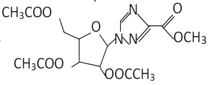 ,分子中的含氧官能团有醚键和酯基;
,分子中的含氧官能团有醚键和酯基;
(2)反应I因为反应物用量控制不当,若NH3的量过多,可能会产生副产物![]() ,以甲醇为溶剂时,存在酯交换反应而有杂质草酰胺甲酯
,以甲醇为溶剂时,存在酯交换反应而有杂质草酰胺甲酯![]() 生成,所以反应Ⅰ的溶剂使用乙醇而不用甲醇;
生成,所以反应Ⅰ的溶剂使用乙醇而不用甲醇;
(3)反应Ⅱ为B与水合肼的醇溶液发生已知反应①生成C(C2H5O2N3)和C2H5OH,属于取代反应;
(4)根据上述分析可知,D与CH3OH/HCl发生已知反应②生成E(C4H5O2N3),反应方程式为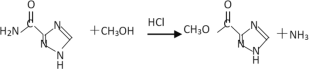 ;
;
(5)G为A的同分异构体,则G的分子式为C6H10O4,1molG与足量NaHCO3反应生成标准状况下44.8LCO2,则1molG分子中含有2mol羧基(—COOH),则其同分异构体中,当主链为—CH2CH2CH2CH2—时,两个—COOH连接时,有6种不同的结构,当主链为—CH2CH(CH3)CH2—时,两个—COOH连接时,有3种不同的结构,则符合条件的G的同分异构体共有6+3=9种;
(6)以甘油、乙醇和![]() 为原料制备
为原料制备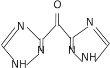 时,可先将甘油催化氧化得到
时,可先将甘油催化氧化得到![]() ,
,![]() 再催化氧化得到
再催化氧化得到![]() ,
,![]() 与乙醇在浓硫酸加热的条件下发生酯化反应生成
与乙醇在浓硫酸加热的条件下发生酯化反应生成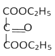 ,
,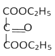 再与水合肼的醇溶液发生已知反应①生成
再与水合肼的醇溶液发生已知反应①生成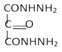 ,
,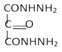 再与OHC-NH2反应生成目标产物
再与OHC-NH2反应生成目标产物 ,则其合成路线可设计为:
,则其合成路线可设计为: 。
。


科目:高中化学 来源: 题型:
【题目】科学家提出由 WO3 催化乙烯和 2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
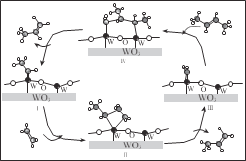
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHCO3和Na2CO3的性质,以下叙述错误的是
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自2020年7月1日起,在全国范围内实行轻型汽车国Ⅵ排放标准,该标准对氮氧化物、碳氢化物(HC)、一氧化碳和悬浮粒子等排放物的限制将更为严苛。
(1)空燃比(A/F:空气质量与燃油质量之比)对尾气排放、发动机动力等都有很大影响。利用氧传感器测定可找到最佳空燃比区域(曲线如图1)。由图可知最佳空燃比区域为___附近,理由是________。推广使用无铅汽油的优点是____________。

(2)汽车尾气通过三元催化装置净化的原理是:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H1
2CO2(g)+N2(g) △H1
已知:① N2(g)+O2(g)=2NO(g) △H2
② C(s)+O2(g)=CO2(g) △H3
③ C(s)+![]() O2(g)=CO(g) △H4
O2(g)=CO(g) △H4
则△H1=_______(用含△H2、△H3、△H4的关系式表示)。
(3)选择性催化还原技术(SCR)利用氨或尿素将NOx还原为N2和H2O,原理是:NO(g)+NO2(g)+2NH3(g) ![]() 3H2O(g)+2N2(g) △H
3H2O(g)+2N2(g) △H
①其他条件不变时,NO的转化率与温度、压强的关系如图2所示。则△H_____0,p1 ____ p2(填“>”或“<”)。
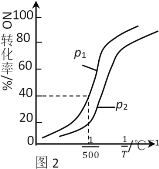
②在500℃时,2L密闭容器中充入1molNO、1molNO2和2molNH3,达平衡时压强为p1MPa。则500℃时该反应的平衡常数Kp=_______。
(4)汽车尾气中还存在NH3等,含氮化合物广泛应用于化工、化肥、制药等领域。
①已知N2H4在水溶液中的一级电离方程式为N2H4H2O![]() +OH-,则
+OH-,则![]() 的电子式为________________。
的电子式为________________。
②已知:Ag+(aq) +2NH3(aq)[Ag(NH3)2]+(aq),其平衡常数表达式为Kf =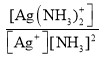 =1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:
=1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:![]() ≈3.16)。
≈3.16)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有强还原性。下列说法正确的是( )
A.NaH2PO2属于酸式盐,其水溶液呈碱性
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2 + 3OH- =![]() + 3H2O
+ 3H2O
C.向NaH2PO2溶液中滴加浓硝酸反应的离子方程式为:![]() + H+=H3PO2
+ H+=H3PO2
D.利用 (H3PO2)进行化学镀银反应中,1molH3PO2 最多还原 4 mol Ag+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水的质量关系到关系到每个人的健康,因含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能,为了降低饮用水中NO3-的浓度,某兴趣小组提出如图方案:
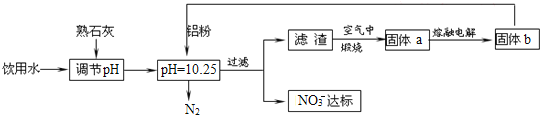
请回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(胃酸的主要成分是HCl)作用下转化成亚铁盐。写出该反应的离子方程式:____。
(2)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为__。
(3)该方案中选用熟石灰调节pH,理由是___、___。
(4)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为___。
(5)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图,试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____。
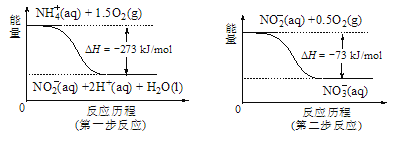
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。一定条件下,如图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其他有机物生成)。电流效率=(生成目标产物消耗的电子数/转移的电子总数)×100%,则下列说法错误的是( )
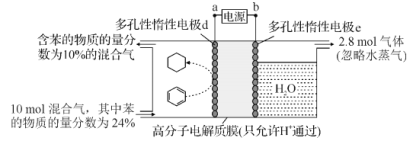
A.电子移动方向为:a→d;e→b
B.d电极反应式为C6H6+6H++6e-=C6H12
C.该储氢装置的电流效率明显小于100%,其原因可能是除目标产物外,还有H2生成
D.由图中数据可知,此装置的电流效率约为32.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列粒子在相应条件下可大量共存的是( )
A.0.1 mol·L-1FeCl3溶液中:K+、Na+、SO![]() 、AlO
、AlO![]()
B.![]() =1的溶液中:Fe2+、NO
=1的溶液中:Fe2+、NO![]() 、Al3+、Cl-
、Al3+、Cl-
C.0.1 mol·L-1盐酸的澄清透明溶液中:Fe3+、K+、SO![]() 、Br-
、Br-
D.含有0.1 mol·L-1Ca2+的溶液中:Na+、Cu2+、SiO![]() 、NO
、NO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com