
【题目】(1)相同物质的量的O2和O3的质量比______,分子个数比为_______,所含氧原子的个数比为_______。
(2)在200 mL 2 mol·L-1MgCl2溶液中,溶质的质量为_______。Cl-的物质的量浓度为__________。
【答案】2:3 1:1 2:3 38g 4mol/L
【解析】
(1)依据n=![]() =
=![]() ,结合臭氧三原子分子、氧气双原子分子解答;
,结合臭氧三原子分子、氧气双原子分子解答;
(2)依据n=cV,m=nM,结合氯化镁为强电解质,完全电离,1mol氯化镁含有2mol氯离子解答。
(1)依据n=![]() =
=![]() 可知,物质的量相等,物质的质量与摩尔质量成正比;分子数与物质的量成正比,所以相同物质的量的O2和O3的质量比为32:48=2:3;分子数之比为1:1;臭氧三原子分子、氧气双原子分子,所以相同物质的量的O2和O3的所含氧原子的个数比为:1×2:1×3=2:3;故答案为:2:3;1:1;2:3;
可知,物质的量相等,物质的质量与摩尔质量成正比;分子数与物质的量成正比,所以相同物质的量的O2和O3的质量比为32:48=2:3;分子数之比为1:1;臭氧三原子分子、氧气双原子分子,所以相同物质的量的O2和O3的所含氧原子的个数比为:1×2:1×3=2:3;故答案为:2:3;1:1;2:3;
(2)在200mL 2mol/L MgCl2溶液中,溶质的质量为:2mol/L×0.2L×95g/mol=38g;氯化镁为强电解质,完全电离,1mol氯化镁含有2mol氯离子,氯化镁溶液中氯离子物质量浓度等于氯化镁物质的量浓度2倍,为4 mol/L;故答案为:38g;4mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
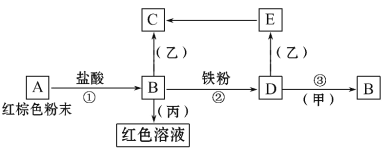
已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:A___,D___,甲___,丙___。
(2)写出红棕色粉末的一种用途___。
(3)写出E→C反应的化学方程式___。
(4)将饱和的B溶液滴入沸水中所得分散系中分散质颗粒直径范围为___。
(5)写出反应②的离子方程式___,该反应中,如果有5.6g铁粉完全反应则生成D的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关(科学探究)为基础,设计了如图实验装置并记录相关实验数据。
(实验装置)
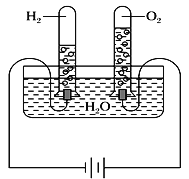
(部分实验数据)
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)在该实验条件下,3 mol O2的气体的体积为____________L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在18电子的化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是___,Y2X6所含有的化学键类型是___。
(2)写出X2W2的电子式___;Z2X4结构式___。
(3)用电子式描述M2N化合物的形成程_____。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为____。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式____。
(6)熔融盐燃料电池具有高的发电效率,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,YW为负极燃气,空气和YW2的混合气体为正极助燃气,制得在650℃下工作的燃料电池。电池工作时的负极反应式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。如图是在实验室中制备KMnO4晶体的流程:
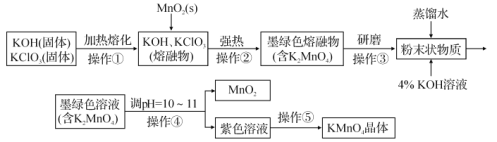
回答下列问题:
(1)在实验流程中,操作①和②均需在坩埚中进行,根据实验实际应选择___(填序号)。
a.铁坩埚 b.石英坩埚 c.瓷坩埚 d.氧化铝坩埚
(2)“熔融物”中KClO3应过量的原因除了提高MnO2利用率外,还有_______。
(3)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为___。若溶液碱性过强,则![]() 又会转化为
又会转化为![]() ,同时产生无色气体,该转化过程中发生反应的离子方程式为___。
,同时产生无色气体,该转化过程中发生反应的离子方程式为___。
(4)还可采用电解K2MnO4溶液(绿色)的方法制备KMnO4(装置如图所示)。
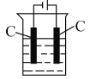
①电解过程中右侧石墨电极的电极反应式为________。
②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是________。
③为避免该现象,请提出改进装置的措施:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法和结论正确的是 ( )
A. 加入硝酸银溶液有白色沉淀生成,证明原溶液中一定有Cl-
B. 在加入稀硝酸后的溶液中,再滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定有SO![]()
C. 加入盐酸后加热,放出能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含有CO![]()
D. 加入紫色石蕊试液,溶液显红色,证明溶液一定呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2
③CH4(g)+![]() O2(g)═CH3OH(l)△H3
O2(g)═CH3OH(l)△H3
④H2O(g)═H2O(l)△H4
⑤CH3OH(l)+![]() O2(g)═CO2(g)+2H2O(l)△H5
O2(g)═CO2(g)+2H2O(l)△H5
下列关于上述反应焓变的判断不正确的是( )
A.△H1>△H2B.△H2=△H1+△H4C.△H3=△H2﹣△H5D.△H4<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
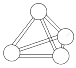
A. N4分子属于一种新型的化合物B. N4分子中只含有非极性键
C. 1 mol N4分子所含共价键数为4NAD. N4沸点比P4(白磷)高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。
(1)蛋白质是人体必需的营养物质,它在人体内最终分解为_______
A.葡萄糖 B.氨基酸 C.脂肪酸
(2)现有下列五种物质:
A.食盐 B.食醋 C.苹果汁 D.葡萄糖 E.青霉素
请按下列要求填空(填序号)。
富含维生素C的是________;可直接进入血液,补充能量的是_______ ;应用最广泛的抗生素之一的是_______;即可作为调味剂,又可作为防腐剂的是_______;食用过多会引起血压升高、肾脏受损的_________。
(3)鸡蛋含有丰富的蛋白质,它在人体内消化过程如下:
![]()
请回答下列问题:
a.向鸡蛋清溶液中滴入几滴浓硝酸,微热,鸡蛋清变为________色。
b.氨基酸具有两性,是因为氨基酸分子中既含有碱性官能团又含有酸性官能团,其中,碱性官能团是____________,酸性官能团是____________。
c.向鸡蛋清溶液中加入饱和Na2SO4溶液,有白色沉淀产生,发生的是_______(填“盐析”或“变性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com