
【题目】已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在18电子的化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是___,Y2X6所含有的化学键类型是___。
(2)写出X2W2的电子式___;Z2X4结构式___。
(3)用电子式描述M2N化合物的形成程_____。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为____。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式____。
(6)熔融盐燃料电池具有高的发电效率,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,YW为负极燃气,空气和YW2的混合气体为正极助燃气,制得在650℃下工作的燃料电池。电池工作时的负极反应式为:____。
【答案】第二周期第ⅣA族 极性键和非极性键或共价键 ![]()
![]()
![]() H+ +HSO3-=SO2↑+H2O N2H4 +2H2O2=N2↑+4H2O CO+CO32--2e-=2CO2
H+ +HSO3-=SO2↑+H2O N2H4 +2H2O2=N2↑+4H2O CO+CO32--2e-=2CO2
【解析】
根据在18电子的化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,可知X为H;Y为C;Z为N;W为O;X与M、W与N分别同主族,X、Y、Z、W、M、N为短周期元素且原子序数依次增大,确定M为Na;N为S;总结X为H、Y为C、Z为N、W为O、M为Na、N为S,据此分析。
(1)Y元素为C,在周期表中的位置是第二周期第ⅣA主族,Y2X6(C2H6)的结构式为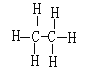 , 所含有的化学键类型是极性键和非极性键或共价键;
, 所含有的化学键类型是极性键和非极性键或共价键;
答案:第二周期第ⅣA族 极性键和非极性键或共价键;
(2)分子内各原子最外层电子都满足稳定结构,X2W2(H2O2)的电子式![]() ;Z2X4(N2H4)结构式
;Z2X4(N2H4)结构式![]() ;
;
答案:![]()
![]()
(3)Na2S为离子化合物,用电子式书写表示形成过程为![]() ;
;
答案:![]()
(4)均含X、W、M、N四种元素的两种化合物为NaHSO4和NaHSO3相互反应有SO2气体放出,反应的离子方程式为H+ +HSO3-=SO2↑+H2O;
答案:H+ +HSO3-=SO2↑+H2O;
(5)N2H4与H2O2反应生成氮气和水,二者反应的方程式为N2H4 +2H2O2=N2↑+4H2O;
答案:N2H4 +2H2O2=N2↑+4H2O;
(6)可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气和CO2的混合气体为正极助燃气,负极电极反应式为 CO+CO32--2e-=2CO2,正极电极反应式为2CO2+O2+4e-=2CO32-,总反应方程式为2CO+O2=2CO2;
答案:.CO+CO32--2e-=2CO2


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右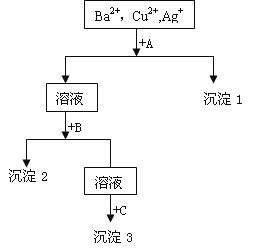
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前可采用“双极膜组”电渗析法淡化海水,同时获得副产品A和B。其模拟工作原理如图所示。M、N为离子交换膜,在直流电作用下,双极阴阳膜(BP)复合层间的H2O解离成H+和OH-,作为H+和OH-的离子源。下列说法正确的是

A.Y电极为阳极,电极反应式为2Cl――2e-=Cl2↑
B.M为阳离子交换膜,N为阴离子交换膜,BP膜作用是选择性通过Cl-和Na+
C.电路中每生成0.25 mol气体a,理论上获得副产品A和B各1 mol
D.“双极膜组”电渗析法也可应用于从盐溶液(MX)制备相应的酸(HX)和碱(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. M为电源负极,有机物被氧化
B. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
C. 电池工作时,N极附近溶液pH增大
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有强还原性。下列说法正确的是( )
A.NaH2PO2属于酸式盐,其水溶液呈碱性
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2 + 3OH- =![]() + 3H2O
+ 3H2O
C.向NaH2PO2溶液中滴加浓硝酸反应的离子方程式为:![]() + H+=H3PO2
+ H+=H3PO2
D.利用 (H3PO2)进行化学镀银反应中,1molH3PO2 最多还原 4 mol Ag+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
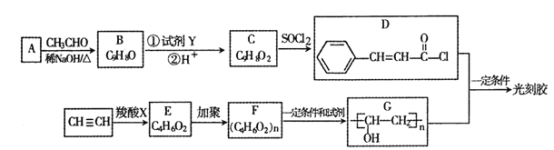
【题目】光刻胶是微电子技术中微细图形加工的关键材料之一,其合成路线如下(部分试剂和产物已略去):
已知:I.![]() +
+ ![]()
![]()
![]() +H2O(R1,R2为烃基或氢)
+H2O(R1,R2为烃基或氢)
II.![]() +R2OH
+R2OH![]()
![]() +HCl(R1,R2为烃基)
+HCl(R1,R2为烃基)
(1)A的结构笱式________,B中所含官能团的名称为_______。
(2)乙炔和羧酸X发生加成反应生成E,E能发生水解反应,则E的结构简式为_______。
(3)B→C所需的试剂Y 和反应条件分别为 __________、____________;由F到G反应类型为______________。
(4)D和G反应生成光刻胶的化学方程式为________。
(5)T是C的同分异构体 T具有下列性质或特征:①能发生银镜反应和水解反应;②分子结构中除苯环外无其他环。则符合条件的T的结构有_______种,其中核磁共振氢谱为 5 组峰,且峰面积比为1:1:2: 2所有的结构简式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的O2和O3的质量比______,分子个数比为_______,所含氧原子的个数比为_______。
(2)在200 mL 2 mol·L-1MgCl2溶液中,溶质的质量为_______。Cl-的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,下列结论正确的是
2PbSO4+2H2O,下列结论正确的是
A. Pb为正极被氧化
B. SO42-只向PbO2极移动
C. 电解质溶液密度不断减小
D. 溶液的pH不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学又称环境友好化学,它的主要特点之一是提高原子的利用率,使原料中所有的原子全部 转化到产品中,实现“零排放”。下列反应符合绿色化学这一特点的是
A. 工业冶炼 Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. 用生石灰制熟石灰 CaO+H2O=Ca(OH)2
C. 实验室制取二氧化碳 CaCO3+2HCl=CaCl2+H2O+CO2↑
D. 实验室制取氢气 Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com