
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右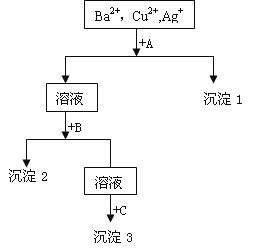
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
【答案】AgCl Cu(OH)2(或BaSO4) BaSO4)(或Cu(OH)2) Ag++Cl-== AgCl Cu2++2OH-== Cu(OH)2(或SO42-+Ba2+==BaSO4)
【解析】
要使Ba2+、Cu2+、Ag+逐一沉淀分离,必须考虑除杂试剂的加入顺序。由于OH-、SO42-均能同时与两种阳离子生成沉淀,故应先加入盐酸。除去Ag+,反应的离子方程式:
Ag++Cl-=AgCl↓,然后再加NaOH(或Na2SO4),除去Cu2+(或Ba2+)。
(1)由于OH-、SO42-均能同时与两种阳离子生成沉淀,故应先加入盐酸。第一种沉淀是AgCl,Ba2+、Cu2+分别与SO42-、OH-生成沉淀,不存在顺序关系,故第二种沉淀Cu(OH)2(或BaSO4),第三种沉淀为BaSO4 (或Cu(OH)2);
(2)溶液+A生成氯化银沉淀的离子方程式为:Ag++Cl-=AgCl;溶液+B的离子方程式则两个均可以,答案为:Cu2++2OH-== Cu(OH)2(或SO42-+Ba2+==BaSO4)。


科目:高中化学 来源: 题型:
【题目】某化学小组为研究甲醛和新制Cu(OH)2反应,进行如下探究,该小组设计下图装置(气密性良好并进行实验:向试管中依次加入6molL-1NaOH溶液12mL0.5molL-1CuSO4溶液8mL,振荡,再加入40%的甲醛溶液6mL,放入65°C水浴中加热,20min后冷却至室温;反应过程中观察到有红色固体生成,有少量气体产生并收集该气体。回答下列问题:
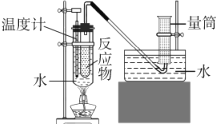
已知:Cu2O易溶于浓氨水形成[Cu ( NH3)4]+(无色),它在空气中能被氧化为[Cu(NH3)4]2+(蓝色)。
(1)实验中NaOH溶液过量的目的是__________。使用水浴加热的目的是_______________。
(2)跟乙醛与氢氧化铜的反应相似,甲醛和新制Cu (OH)2反应的产物为甲酸钠、氧化亚铜和水。该小组同学通过查阅资料发现,甲醛和新制Cu(OH)2还能发生下列反应:
HCHO+Cu(OH)2![]() Cu+CO↑+2H2O
Cu+CO↑+2H2O
HCHO+4Cu(OH)2+2NaOH![]() 2Cu2O+Na2CO3+6H2O
2Cu2O+Na2CO3+6H2O
小组同学对实验中红色固体产物的组成作出猜想:铜或氧化亚铜或它们的混合物;为了验证固体产物,设计如下实验方案并进行实验(以下每步均充分反应):
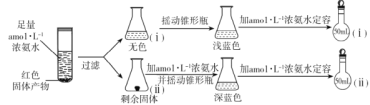
①摇动锥形瓶 i 的目的是_________。
②锥形瓶 ii 中固体完全溶解得到深蓝色溶液的离子方程式为__________。
③将容量瓶 ii 中的溶液稀释 100 倍后,溶液的颜色与容量瓶 i 相近。由此可知固体产物的组成及物质的量之比约为__。
(3)为进一步确认生成的气体是CO,将收集的气体利用如图所示的装置进行实验(部分夹持仪器略去)。
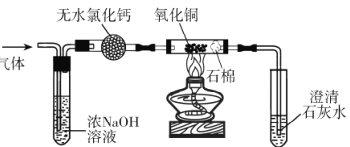
①无水氯化钙的作用是______。
②实验中“先通气,后加热” 的目的是_____。
③证明气体是CO的现象________。
(4)甲醛与氢氧化铜反应的实验中,甲醛可能被氧化的产物为甲酸钠或碳酸钠。请设计实验方案证明溶液中甲醛的氧化产物:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)![]() 2C(g),已知起始投入4molA(g) 和2 mol B(g),经2 s后测得C的浓度为0.6 mol/L,并且2 s后各组分浓度不再改变。下列说法正确的是
2C(g),已知起始投入4molA(g) 和2 mol B(g),经2 s后测得C的浓度为0.6 mol/L,并且2 s后各组分浓度不再改变。下列说法正确的是
A.2 s内用物质A表示的平均反应速率为0.6 mol/(Ls)
B.2 s内用物质B表示的平均反应速率为0.6 mol/(Ls)
C.2 s后每有0.6 mol的物质B生成,同时就有0.6 mol物质C生成
D.2 s时物质B的浓度为0.7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍广泛应用于电镀、电池、催化剂等工业。某科研小组以粗硫酸镍(含Cu2+、Fe3+、Ca2+、Mg2+、Zn2+等)为原料,经如图一系列除杂过程模拟精制硫酸镍工艺。回答下列问题。

(1)滤渣1的主要成分是__(写化学式),写出“硫化除铜”过程中发生的氧化还原反应的离子方程式___。
(2)“氧化除杂”时加入Cl2和Ni(OH)2的作用分别是___。
(3)已知25℃时,Ksp[CaF2]=3.95×10-11;Ksp[MgF2]=6.40×10-9。则“氟化除杂”过后滤液3中 =__。(保留三位有效数字)
=__。(保留三位有效数字)
(4)“萃取”时使用萃取剂R在硫酸盐中对某些金属离子的萃取率与溶液pH的关系如图。则实验时需控制的pH适宜范围是___(填字母序号)。
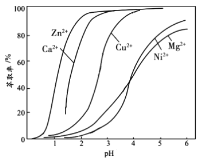
A.1~2 B.3~4 C.4~5 D.5~6
(5)将萃取后所得富含硫酸镍的溶液经操作A可得硫酸镍晶体,则操作A为___、___、过滤、洗涤等。
(6)称取2.000g硫酸镍晶体(NiSO4·6H2O)样品溶解,定容至250mL。取25.00mL试液,用0.0200mol·L-1的EDTA(Na2H2Y)标准溶液滴定至终点。重复实验,平均消耗EDTA标准溶液体积为36.50mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为__%。(保留三位有效数字,且不考虑杂质反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
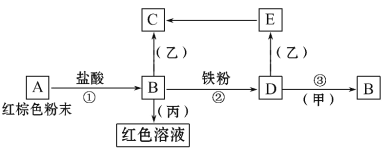
已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:A___,D___,甲___,丙___。
(2)写出红棕色粉末的一种用途___。
(3)写出E→C反应的化学方程式___。
(4)将饱和的B溶液滴入沸水中所得分散系中分散质颗粒直径范围为___。
(5)写出反应②的离子方程式___,该反应中,如果有5.6g铁粉完全反应则生成D的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A.CH3CH(CH3)CH2CH2OH名称为:3-甲基丁醇
B.![]() 一氯代物有5种
一氯代物有5种
C.标准状况下,22.4L丙烯中含有7NA个σ键,NA个π键
D. 能发生消去反应,其产物有2种
能发生消去反应,其产物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在18电子的化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是___,Y2X6所含有的化学键类型是___。
(2)写出X2W2的电子式___;Z2X4结构式___。
(3)用电子式描述M2N化合物的形成程_____。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为____。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式____。
(6)熔融盐燃料电池具有高的发电效率,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,YW为负极燃气,空气和YW2的混合气体为正极助燃气,制得在650℃下工作的燃料电池。电池工作时的负极反应式为:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com