
【题目】某化学小组为研究甲醛和新制Cu(OH)2反应,进行如下探究,该小组设计下图装置(气密性良好并进行实验:向试管中依次加入6molL-1NaOH溶液12mL0.5molL-1CuSO4溶液8mL,振荡,再加入40%的甲醛溶液6mL,放入65°C水浴中加热,20min后冷却至室温;反应过程中观察到有红色固体生成,有少量气体产生并收集该气体。回答下列问题:
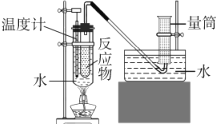
已知:Cu2O易溶于浓氨水形成[Cu ( NH3)4]+(无色),它在空气中能被氧化为[Cu(NH3)4]2+(蓝色)。
(1)实验中NaOH溶液过量的目的是__________。使用水浴加热的目的是_______________。
(2)跟乙醛与氢氧化铜的反应相似,甲醛和新制Cu (OH)2反应的产物为甲酸钠、氧化亚铜和水。该小组同学通过查阅资料发现,甲醛和新制Cu(OH)2还能发生下列反应:
HCHO+Cu(OH)2![]() Cu+CO↑+2H2O
Cu+CO↑+2H2O
HCHO+4Cu(OH)2+2NaOH![]() 2Cu2O+Na2CO3+6H2O
2Cu2O+Na2CO3+6H2O
小组同学对实验中红色固体产物的组成作出猜想:铜或氧化亚铜或它们的混合物;为了验证固体产物,设计如下实验方案并进行实验(以下每步均充分反应):
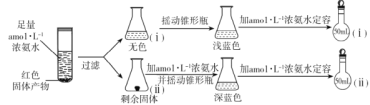
①摇动锥形瓶 i 的目的是_________。
②锥形瓶 ii 中固体完全溶解得到深蓝色溶液的离子方程式为__________。
③将容量瓶 ii 中的溶液稀释 100 倍后,溶液的颜色与容量瓶 i 相近。由此可知固体产物的组成及物质的量之比约为__。
(3)为进一步确认生成的气体是CO,将收集的气体利用如图所示的装置进行实验(部分夹持仪器略去)。
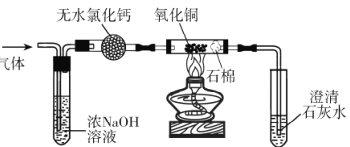
①无水氯化钙的作用是______。
②实验中“先通气,后加热” 的目的是_____。
③证明气体是CO的现象________。
(4)甲醛与氢氧化铜反应的实验中,甲醛可能被氧化的产物为甲酸钠或碳酸钠。请设计实验方案证明溶液中甲醛的氧化产物:__。
【答案】提供碱性溶液环境或OH-与Cu(OH)2反应生成[Cu(OH)4]2- 受热均匀便于控制温度 有利于溶液与空气中的氧气接触 2Cu+8NH3H2O+O2=2[Cu(NH3)4]2++ 4OH-+ 6 H2O n(Cu2O):n(Cu)=1:200 吸收水蒸气 排尽装置中的空气, 防止加热时发生爆炸 黑色粉末变为红色 , 澄清的石灰水变浑浊 取少量反应后的澄清溶液于试管中,滴入过量的盐酸,若无气泡产生,说明甲醛被氧化成甲酸钠,若有气泡产生,说明甲醛被氧化为碳酸钠
【解析】
根据题干信息分析可知,实验中向试管依次加入6molL-1NaOH溶液12mL,0.5molL-1CuSO4溶液8mL,可知,碱过量,振荡发生反应Cu2++2OH-=Cu(OH)2↓,碱性条件下再加入40%的甲醛溶液6mL,放入65°C水浴中加热,发生反应2Cu(OH)2+HCHO+NaOH![]() Cu2O↓+3H2O+HCOONa,也可能发生反应HCHO+Cu(OH)2
Cu2O↓+3H2O+HCOONa,也可能发生反应HCHO+Cu(OH)2![]() Cu+CO↑+2H2O,HCHO+4Cu(OH)2+2NaOH
Cu+CO↑+2H2O,HCHO+4Cu(OH)2+2NaOH![]() 2Cu2O↓+Na2CO3+6H2O,因此红色固体可能是Cu2O和Cu的混合物,气体为CO,可根据已知“Cu2O易溶于浓氨水”验证固体产物,根据CO具有还原性验证气体为CO,据此分析解答问题。
2Cu2O↓+Na2CO3+6H2O,因此红色固体可能是Cu2O和Cu的混合物,气体为CO,可根据已知“Cu2O易溶于浓氨水”验证固体产物,根据CO具有还原性验证气体为CO,据此分析解答问题。
(1)由上述分析,实验中NaOH的目的是提供碱性溶液环境或OH-与Cu(OH)2反应生成[Cu(OH)4]2-,水浴加热的目的是使受热均匀便于控制温度;
(2)①已知[Cu(NH3)4]+在空气中能被氧化为[Cu(NH3)4]2+,摇动锥形瓶ⅰ有利于溶液与空气中的氧气接触;
②剩余固体为Cu,与浓氨水反应生成深蓝色的四氨合铜离子,反应的离子方程式为2Cu+8NH3H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
③将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近,说明ii中的溶液的浓度是i中的溶液的100倍,又Cu2O~2[Cu(NH3)4]2+,Cu~[Cu(NH3)4]2+,则有n(Cu2O):n(Cu)=1:200;
(3)①无水氯化钙可吸收CO气体中混有的水蒸气;
②CO与空气混合加热可能会爆炸,有安全隐患,因此实验中“先通气,后加热目的是为了”排尽装置中的空气,防止加热时发生爆炸;
③CO具有还原性,可与黑色的CuO发生氧化还原反应生成红色的铜,并生成CO2气体,因此气体是CO的现象为黑色粉末变为红色,澄清的石灰水变浑浊;
(4)甲醛可能被氧化的产物为甲酸钠或碳酸钠,碳酸钠可与盐酸反应生成CO2气体,而甲酸钠不可以,因此证明溶液中甲醛的氧化产物时,可取少量反应后的澄清溶液于试管中,滴入过量的盐酸,若无气泡产生,说明甲醛被氧化成甲酸钠,若有气泡产生,说明甲醛被氧化为碳酸钠。


科目:高中化学 来源: 题型:
【题目】氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及 氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为 ____
(2)单质X的化学式是_______,吸收塔中X的作用是 ____。
(3)工业上为了储运浓硝酸,最好选择____作为罐体材料。
A.铜 B.铂 C.铝 D.镁
(4)为避免硝酸生产尾气中的氮氧化物污染环境,工业上常用Na2CO3吸收尾气,发生 的反应为:NO+NO2+Na2CO3=2NaNO2+CO2、2NO2+Na2CO3=NaNO2 + NaNO3+CO2,将标准状况下44.8 L仅含NO和NO2混合气体的尾气通入Na2CO3溶液中,尾气被 完全吸收,则消耗的Na2CO3的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式和化学方程式是学习化学的基本用语,请按要求书写:
(1)写出下列反应的离子方程式
①向石灰石滴加盐酸________________;
②硅酸钠溶液中滴加稀盐酸__________。
(2)写出下列离子反应方程式所对应的化学方程式
①![]() ________________;
________________;
②![]() ____________________
____________________
(3)写出稀硝酸与铜反应的化学方程式____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是
A. 两种气体A与B的相对分子质量之比为m∶n
B. 同质量气体A与B的分子数之比为n∶m
C. 同温同压下,A、B两气体的密度之比为n∶m
D. 相同状况下,同体积A、B两气体的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列装置图回答问题(装置图用符号表示):

(1)双氧水(H2O2)是无色液体,可发生如下化学反应:![]() 。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
。反应中MnO2的作用是________。在实验室利用此反应制取氧气时,应选用的气体发生装置是________,简述检查本装置气密性的方法:______________________________________________。
(2)KClO3在MnO2作催化剂时,加热也可以制得氧气。应选用的气体发生装置是________。
(3)为了验证MnO2在KClO3分解过程中起到了催化剂作用,我们要把反应后的产物分离,提取出MnO2并验证其的确是催化剂。分离出MnO2的操作有________、________、洗涤、烘干、称量。为证明MnO2是催化剂,还需要知道的一个数据是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙属于一种桥环化合物,是某些医药的中间体,可以通过如图反应制得,下列有关说法正确的是

A.乙分子中所有碳原子可能处于同一平面上
B.乙可与H2按物质的量之比1∶2发生加成反应
C.丙是一种油脂,能发生皂化反应
D.甲和苯都能使溴水褪色,且原理一样
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右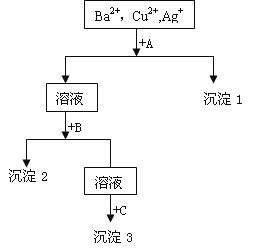
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com