
【题目】氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及 氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为 ____
(2)单质X的化学式是_______,吸收塔中X的作用是 ____。
(3)工业上为了储运浓硝酸,最好选择____作为罐体材料。
A.铜 B.铂 C.铝 D.镁
(4)为避免硝酸生产尾气中的氮氧化物污染环境,工业上常用Na2CO3吸收尾气,发生 的反应为:NO+NO2+Na2CO3=2NaNO2+CO2、2NO2+Na2CO3=NaNO2 + NaNO3+CO2,将标准状况下44.8 L仅含NO和NO2混合气体的尾气通入Na2CO3溶液中,尾气被 完全吸收,则消耗的Na2CO3的物质的量为_____mol。
【答案】3H2+N2![]() 2NH3 O2 将氮氧化物充分氧化为HNO3 C 1
2NH3 O2 将氮氧化物充分氧化为HNO3 C 1
【解析】
(1)氮气和氢气在合成塔中生成氨气;
(2)氧化炉中氨气催化氧化得到一氧化氮,吸收塔中一氧化氮被氧气氧化为二氧化氮,二氧化氮和水反应可以得到硝酸;
(3)硝酸具有强氧化性,能氧化除金、铂以外的大多数金属,常温下,铁、铝在浓硝酸中钝化而阻止进一步被氧化;
(4)由方程式可知Na2CO3溶液与NO和NO2反应生成NaNO2和NaNO3混合液,由N原子和Na原子个数守恒计算可得。
(1)氮气和氢气在合成塔中生成氨气,反应的化学方程式为3H2+N2![]() 2NH3,故答案为:3H2+N2
2NH3,故答案为:3H2+N2![]() 2NH3;
2NH3;
(2)氧化炉中氨气催化氧化得到一氧化氮,吸收塔中一氧化氮被氧气氧化为二氧化氮,二氧化氮和水反应可以得到硝酸,则X为氧气,吸收塔中氧气的作用是将氮氧化物充分氧化为HNO3,故答案为:O2;将氮氧化物充分氧化为HNO3;
(3)硝酸具有强氧化性,能氧化除金、铂以外的大多数金属,常温下,铁、铝在浓硝酸中钝化而阻止进一步被氧化,由于铂是贵重金属,所以工业上为了储运浓硝酸最好选择铝作为罐体材料,故答案为:C;
(4)44.8 L NO和NO2混合气体的物质的量为![]() =2mol,由N原子个数守恒可知,NaNO2和NaNO3的物质的量之和为2mol,由Na原子个数守恒可知,消耗Na2CO3的物质的量为2mol×
=2mol,由N原子个数守恒可知,NaNO2和NaNO3的物质的量之和为2mol,由Na原子个数守恒可知,消耗Na2CO3的物质的量为2mol×![]() =1mol,故答案为:1.
=1mol,故答案为:1.


科目:高中化学 来源: 题型:
【题目】把2.0 mol·L-1 CuSO4和1.0 mol·L1 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度c(CuSO4)=________;c(H2SO4)=________。
(2)混合液中H+和SO42-的物质的量浓度c(H+)=________;c(SO42-)=________。
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度c(Fe2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列大小比较正确的是
平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |
K | 2.50 | 0.34 | 0.15 |
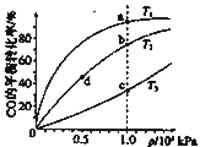
A.平横常数:K(a)>K(c),K(b)=K(d)
B.正反应速率:v(a)>v(c),v(b)=v(d)
C.达到平衡所需时间:t(a)=t(c),t(b)>t(d)
D.平均相对分子质量:M(a)=M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法正确的是( )
A.二氧化氯泡腾片中的NaClO2属于氧化物
B.咳嗽形成的飞沫气溶胶属于胶体分散系
C.口罩熔喷布的原料聚丙烯属于天然有机高分子
D.人工肺中的硅橡胶(如图所示)属于新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.用饱和Na2CO3溶液浸泡CaSO4固体:CO![]() +CaSO4
+CaSO4![]() CaCO3+SO
CaCO3+SO![]()
B.向NH4HCO3溶液中加入足量石灰水:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
C.向CuSO4溶液中加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH![]()
D.用碘化钾淀粉溶液检验亚硝酸钠中NO![]() 的存在:NO
的存在:NO![]() +2I-+2H+=NO↑+I2+H2O
+2I-+2H+=NO↑+I2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用下图所示装置进行实验。以探究苯与溴发生反应的原理并分离提纯反应的产物。

请回答下列问题:
(1)写出装置Ⅱ中发生的主要化学反应方程式____________________________,其中冷凝管所起的作用为导气和________,Ⅳ中球形干燥管的作用是__________。
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。Ⅲ中小试管内苯的作用是_________________________。
(3)能说明苯与液溴发生了取代反应的现象是______________________。
(4)反应结束后,要让装置Ⅰ中的水倒吸入装置Ⅱ中以除去装置Ⅱ中残余的HBr气体。简述如何实现这一操作:______________________________________。
(5)纯净的溴苯是无色油状的液体,这个装置制得的溴苯呈红棕色,原因是里面混有______________,将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。①用蒸馏水洗涤,振荡,分液;②用__________洗涤,振荡,分液;③蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。
(1)Cu+的基态核外电子排布式为___。
(2)BF![]() 的空间构型为___,与其互为等电子体的阴离子是___。
的空间构型为___,与其互为等电子体的阴离子是___。
(3)C、N、B三种元素的电负性由小到大的顺序为___。
(4)[Cu(CH3CN)4]+中配位原子为___。
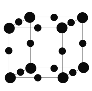
(5)Cu3N的晶胞结构如图所示,则N3-的配位数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为研究甲醛和新制Cu(OH)2反应,进行如下探究,该小组设计下图装置(气密性良好并进行实验:向试管中依次加入6molL-1NaOH溶液12mL0.5molL-1CuSO4溶液8mL,振荡,再加入40%的甲醛溶液6mL,放入65°C水浴中加热,20min后冷却至室温;反应过程中观察到有红色固体生成,有少量气体产生并收集该气体。回答下列问题:
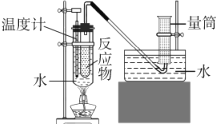
已知:Cu2O易溶于浓氨水形成[Cu ( NH3)4]+(无色),它在空气中能被氧化为[Cu(NH3)4]2+(蓝色)。
(1)实验中NaOH溶液过量的目的是__________。使用水浴加热的目的是_______________。
(2)跟乙醛与氢氧化铜的反应相似,甲醛和新制Cu (OH)2反应的产物为甲酸钠、氧化亚铜和水。该小组同学通过查阅资料发现,甲醛和新制Cu(OH)2还能发生下列反应:
HCHO+Cu(OH)2![]() Cu+CO↑+2H2O
Cu+CO↑+2H2O
HCHO+4Cu(OH)2+2NaOH![]() 2Cu2O+Na2CO3+6H2O
2Cu2O+Na2CO3+6H2O
小组同学对实验中红色固体产物的组成作出猜想:铜或氧化亚铜或它们的混合物;为了验证固体产物,设计如下实验方案并进行实验(以下每步均充分反应):
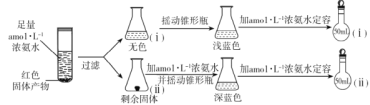
①摇动锥形瓶 i 的目的是_________。
②锥形瓶 ii 中固体完全溶解得到深蓝色溶液的离子方程式为__________。
③将容量瓶 ii 中的溶液稀释 100 倍后,溶液的颜色与容量瓶 i 相近。由此可知固体产物的组成及物质的量之比约为__。
(3)为进一步确认生成的气体是CO,将收集的气体利用如图所示的装置进行实验(部分夹持仪器略去)。
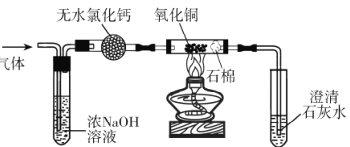
①无水氯化钙的作用是______。
②实验中“先通气,后加热” 的目的是_____。
③证明气体是CO的现象________。
(4)甲醛与氢氧化铜反应的实验中,甲醛可能被氧化的产物为甲酸钠或碳酸钠。请设计实验方案证明溶液中甲醛的氧化产物:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com