
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )
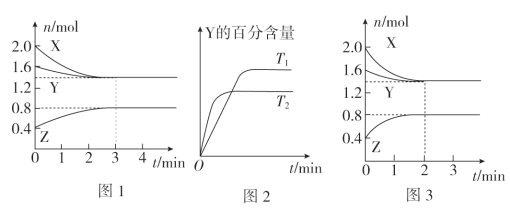
A.容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
【答案】A
【解析】
A、据图1可知,反应中X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,所以X、Y为反应物,Z为生成物,且该反应为可逆反应,根据物质的量的变化量与化学计量数成正比可知0.4mol:0.2mol:0.4mol=3:1:2,所以反应的化学方程式为3X(g)+Y(g)![]() 2Z(g),故A正确;
2Z(g),故A正确;
B、反应进行的前3min内,v(X)=0.6mol÷(2L×3min)=0.1mol/(L·min),故B错误;
C、根据图2中曲线的斜率大小判断,T2时先到达平衡状态,说明反应速率大,根据温度越高反应速率越大说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,则平衡常数增大,故C错误;
D、图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,故D错误。
故选A。


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是
SnI4制备SnI4。下列说法错误的是
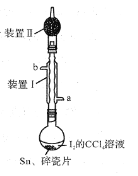
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是_____(填字母)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(2)将320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过________(填操作名称)、干燥后,得到固体2.33 g,气体N与溴水反应的化学方程式为______________________,计算推知气体N中SO2的体积分数为________。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是________,理由是_______________________________(用化学方程式表示)。
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是________________(填字母) ,其中A的作用是_______________,B中试剂X的化学式是________。
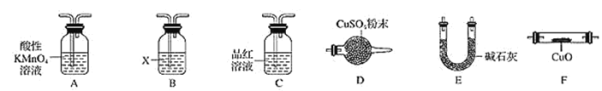
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然脑砂含少量NH4Cl,《唐本草》记载脑砂入药可以散瘀消肿。某学习小组设计下列步骤制取NH4Cl,并进行天然脑砂含量的测定。请回答相关问题:
步骤Ⅰ用氨气与适量氯气反应制取NH4Cl
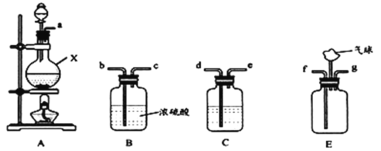
(1)装置A中仪器X的名称为___;若用浓盐酸与MnO2反应制取氯气,则该反应的离子方程式为___。
(2)C中盛放的试剂是___;要得到干燥纯净的氯气,按照气流由左到右的顺序,上述A、B、C装置连接依次为a→___(用小写字母表示)。
(3)氨气与适量氯气混合反应可生成NH4Cl和一种无污染的气体,利用E装置模拟该反应。氨气应从___(用小写字母表示)通入,反应的化学方程式为___;观察到的现象是___。
步骤Ⅱ天然脑砂中NH4Cl含量的测定
准确称取一定质量脑砂,与足量的氧化铜混合,如图所示进行实验。
已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
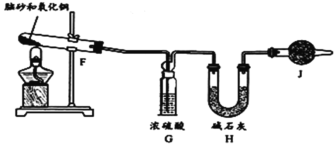
(4)为完成NH4Cl含量的测定,请完成下列实验步骤:
加热前,称量H装置的总质量;当观察到___现象时,停止加热,冷却,___。
(5)如果不用J装置,测出NH4Cl的含量将___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算:
(1)室温下,0.001mol/L的盐酸溶液的PH=____;加水稀释到原来的10倍,pH=_____
(2)室温下,pH=3的CH3COOH溶液加水稀释到原体积的10倍,溶液的pH值范围_____;
(3)室温下,pH=1和pH=3的硫酸等体积混合后溶液的pH=_____(lg2=0.3、lg3=0.477、lg5=0.7)
(4)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液的pH=___
(5)25![]() 时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____
时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。

(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2 mol A和1 mol B,乙中充入2 mol C和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
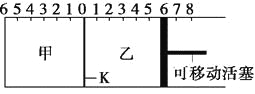
A. 根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B. 达到平衡后,隔板K最终停留在左侧刻度0~2之间
C. 达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D. 若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com